Болезнь минимальных изменений
НС у детей клинически разделяется на стероид-чувствительный (СЧНС) и стероид-резистентный (СРНС) варианты после проведения стандартной терапии преднизолоном [6,7]. Более чем в 90% СЧНС у детей имеет морфологическую основу в виде минимальных изменений (болезнь минимальных изменений, БМИ). БМИ встречается чаще у детей (чаще – мальчики в возрасте 2-5 лет). У взрослых встречается всего в 10-20% случаев (Е.М Шилов, 2010). Поэтому НС у взрослых требует обязательного проведения биопсии почки в самом начале заболевания. У детей с НС биопсия почки проводится, как правило, после установления стероид-резистентности, то есть через 6 недель от начала НС. Началу НС предшествуют различные состояния: острые респираторные заболевания или другие инфекции, аллергические реакции, вакцинация, длительное лечение препаратами, но нередко причина остается неясной.
Патогенез. Большинство исследований свидетельствуют в пользу ведущей роли дисфункции Т-лимфоцитов в иммуногенезе, приводящей к нарушению структуры гломерулярного фильтра. Лимфоциты продуцируют циркулирующий фактор проницаемости, который вызывает повреждение щелевых диафрагм между ножками подоцитов. В результате этого происходит сглаживание ножек подоцитов, которые в норме не пропускают в мочу альбумин, щелевые диафрагмы разрушаются. Подоциты по сути прекращают свою нормальную функцию, приобретая округлую форму, а между ними белок, а именно альбумин, свободно попадает в мочу (протеинурия). С данной теорией согласуется общеизвестный факт эффективности глюкокортикостероидов (ГКС) при БМИ. Механизм действия ГКС, очевидно, связан с блокадой продукции лимфоцитарного фактора, вызывающего повреждение гломерулярного фильтра. При СМ ткани почки: клубочки, сосуды и тубулоинтерстициальное пространство выглядят неизмененными (рис. 4.2). При любых изменениях в тубулоинтерстициальном пространстве, подобных тем, что имеют место при ФСГС, диагноз БМИ становится сомнительным.
При ЭМ выявляются характерные изменения подоцитов: диффузное и глобальное сглаживание ножек подоцитов. Другие структуры клубочка не меняются. В отдельных случаях могут присутствовать небольшие парамезангиальные (в участках ГБМ в области мезангия) электронно-плотные депозиты. При ИГХ исследовании клубочки в основном не окрашиваются, либо фокально и сегментарно выявляются небольшие депозиты IgM и компонентов комплемента (СЗ, C1q, С5-9). Электронно-плотные депозиты, Ig и отложения комплемента, так же как и слияние отростков ножек подоцитов, могут исчезать при ремиссии НС.
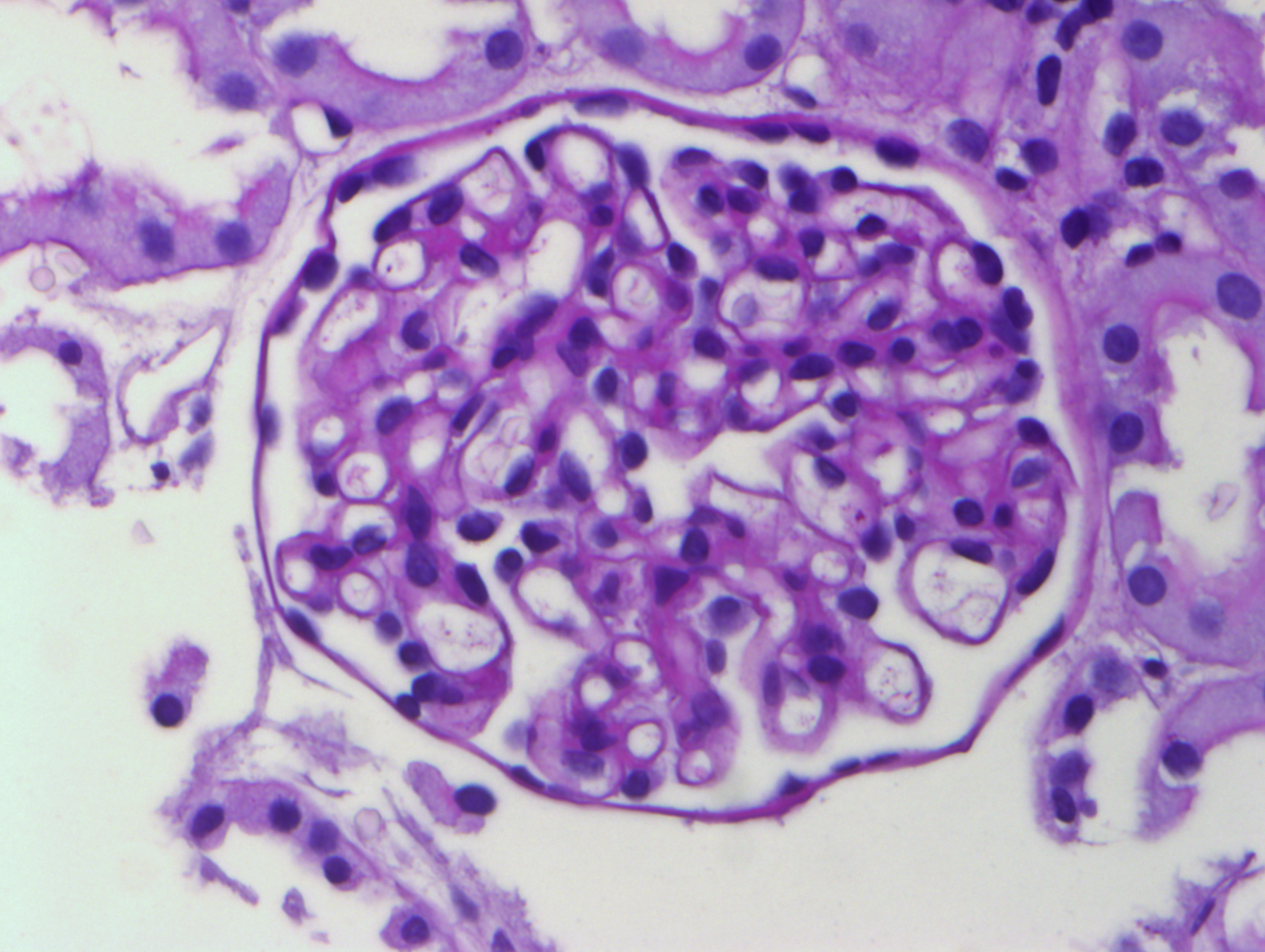 Рисунок 4.2. Болезнь минимальных изменений. Клубочек при световой микроскопии не изменен, PAS х400.
Рисунок 4.2. Болезнь минимальных изменений. Клубочек при световой микроскопии не изменен, PAS х400.
(А.Е Наушабаева., 2009.)
Ребенок О., 5 лет, нефротический синдром, стероидчувствительный вариант.
Клиническая картина. Как правило, первыми симптомами являются снижение диуреза, пенистая моча и отеки лица, голеней, поясницы, которые могут прогрессировать до анасарки. Развитие отеков связано с гипоальбуминемией и падением онкотического давления плазмы крови (рис. 4.3). Возникает онкотический градиент между внутрисосудистой и экстравазальной средой, согласно которому происходит перемещение жидкости в ткани. Кроме того, существует теория, объясняющая перемещение жидкости из внутрисосудистого пространства изменением проницаемости капилляров. В ряде случаев гиповолемия может быть выраженной и приводить к гипоперфузии почек и снижению скорости клубочковой фильтрации (СКФ) и гиперазотемии.
Механизм развития гиперлипидемии до конца не ясен. Предполагается, что гипоальбуминемия приводит к нарушению печеночного метаболизма с повышением синтеза липидов. Иногда НС сочетается с гематурией и/или артериальной гипертензией (АГ), что требует исключения нефритического процесса, хотя данные симптомы описаны примерно у 10% больных с идиопатическим НС. Потери различных веществ с мочой вызывают снижение иммунитета, гипокальциемию, снижение функции щитовидной железы и др. (рис. 4.3).
| Повреждение клубочка |
| Гипопротеинемия |
| Протеинурия |
| - гипогаммаглобулин- емия -> инфекции - ↓ факторов комплемента -> ↓ опсонизации - ↓ АТ III, IX, XI, XII факторов -> гиперкоагуляция - ↓ трансферрина, Т3, Т4, витамина Д |
| Повышение синтеза липидов в печени |
| Гиперлипидемия |
| Гипоальбуминемия |
| Липидурия |
| ↓ онкотического давления |
| ↑ АДГ |
| ↑ РАА |
| ↓ эффективного плазматического объема |
| ↑ симпатического тонуса |
| Задержка Н2О и соли |
Рисунок 4.3. Патогенез нефротического синдрома
К особенностям отеков при НС относится их тестоватая консистенция, массивный характер и склонность к образованию асцита, гидроторакса, гидроперикарда.
Осложнения. Гиповолемия развивается вследствие значительно выраженного отека с катастрофической задержкой жидкости в тканях и недостаточности ее в кровотоке. При уровне альбумина ниже 10-15 г/л и снижении объема циркулирующей жидкости (ОЦК) на 25-30% может развиться гиповолемический шок. Развитию его может способствовать неправильное лечение диуретиками. Определение волемического статуса имеет важное значение для выбора диуретической терапии. Вследствие снижения кровотока в почках развивается преренальное ОПП, повышается уровень азотистых шлаков в крови (креатинин, мочевина), снижается диурез. Гиповолемический шок бывает при назначении диуретиков, особенно когда имеется септицемия, диарея, рвота. Гиповолемический шок можно предположить при наличии разной интенсивности болей в животе, гипотензии, тахикардии, ознобе. В крови повышены уровни гематокрита, мочевины и мочевой кислоты. Восстанавливается путем срочных инфузий физиологического раствора из расчета 15-20мл/кг в течение 20-30 минут, можно повторно. Инфузия 10-20% раствора альбумина (5-10мл/кг) проводится при отсутствии эффекта после двух болюсов физиологического раствора.
Нефротический криз развивается вследствие гиповолемического шока с нарушениями микроциркуляции. Развивается абдоминальный криз – клиника острого живота, на коже – характерные эритемы («кининовый криз»).
Тромбоз, тромбоэмболия могут развиться вследствие гиперкоагуляции, развивающейся на фоне гиповолемии, гиперфибриногенемии и потери с мочой антитромбина III и угнетения фибринолиза. Им способствуют обездвиженность, лечение диуретиками и ГКС. Признаками периферического тромбоза могут быть гиперемия, боль и кожная гиперэстезия. Тромбоз почечной вены проявляется резким увеличением почки, поясничной болью, гипертензией и макрогематурией. Тромбоэмболию легочных и мозговых артерий следует подтвердить визуализирующими исследованиями. К группе риска по тромботическим осложнениям относятся пациенты с уровнем сывороточного альбумина ниже 20 г/л.
Для профилактики и лечения тромбозов особенно у лиц, вынужденных соблюдать постельный режим, назначается лечение гепарином до 100 ед/кг в день или низкомолекулярными гепаринами, либо непрямым антикоагулянтом варфарином под контролем Международного нормализованного отношения (MHO) с целевым уровнем 2-3. Многими рекомендуются антитромбоцитарные препараты или антиагреганты — дипиридамол 4-5 мг/кг или аспирин у старших детей (0,2 мг/кг через день). Больным следует рекомендовать двигательную активность, избегая постельного режима. Как правило, после достижения ремиссии профилактика тромбозов проводится только пациентам с тромботическими осложнениями в анамнезе.
Инфекциивстречаются часто у пациентов с НС из-за вторичного иммунодефицитного состояния, связанного с потерей иммуноглобулинов с мочой и депрессией Т-клеточного звена иммунитета, общих метаболических нарушений и применения иммуносупрессивных препаратов. Помимо частых респираторно-вирусных заболеваний описывают пневмококковый перитонит, инфекцию кожи и подкожной клетчатки на фоне отеков (целлюлит), сепсис, инфекцию мочевыводящих путей, пневмонию и др. Особую опасность представляют собой ветряная оспа и опоясывающий лишай, требующие активного лечения ацикловиром, в/в введением иммуноглобулина против вируса zoster. Несмотря на то, что профилактическое лечение антибиотиками не рекомендуется, при возникновении инфекции следует быстро прибегнуть к антибактериальной или противовирусной терапии с учетом свойств возбудителя. В период ремиссии помимо плановой иммунизации убитыми вакцинами, рассматривается вопрос о профилактике против пневмококка, гепатита В, ежегодно против гриппа (детям и всем проживающим с ними). Детям, получающим ГКС-сберегающую ИС-терапию, противопоказаны живые вакцины [KDIGO, 2012].
Гиперлипидемияможет сопровождаться риском атеросклероза в основном у взрослых, однако и у детей она имеет неблагоприятное значение в случае персистирования в стероидрезистентных случаях. Рекомендуется ограничение животных жиров в диете, включение полиненасыщенных жирных кислот, осторожное применение статинов у детей старшего возраста.
Белково-энергетическая недостаточностьвозможна при длительном ограничении белка в диете, что нецелесообразно у детей.
При тяжелом течении НС могут выявляться транзиторная глюкозурия, аминоацидурия и др., как признак нарушения канальцевой реабсорбции. Однако, как правило, эти нарушения транзиторные и могут быть связаны не только с самим заболеванием, но и с его лечением (ГКС).
Лечение.
1. Следует избегать постельного режима, поскольку он повышает риск тромбообразования.
2. Диета заключается в ограничении натрия. Иногда умеренно ограничивается прием жидкости, пока уровень альбумина ниже 25 г/л из-за нарастания отеков. С учетом потребностей растущего организма, а также из-за отсутствия убедительных доказательств в пользу малобелковой диеты, детям с НС следует рекомендовать нормальный уровень потребления животного белка.
3. Симптоматическая терапия. При значительных отеках применяются петлевые диуретики – фуросемид, торасемид. Фуросемид назначают в дозе 1-3мг/кг/сут в/в 3 раза в день через равные промежутки времени. При рефрактерности к лечению фуросемидом используется сочетание со спироналоктоном или тиазидами, в тяжелых случаях комбинация диуретиков и альбумина. При выборе диуретической терапии необходимо знание волемического статуса. При гиповолемии и наличии рвоты, диареи диуретики не назначают. Потеря альбумина может сопровождаться гипо -, нормо - или гиперволемией. Гиповолемия сопровождается активацией РААС. При этом эффект альдостерона заключается в усилении выведения калия с мочой и задержке в организме натрия. Этот феномен не проявляется при гипер- и нормоволемии. Имеются несколько формул для расчета волемического статуса при НС. Формула Ван де Валле предполагает исследование концентрации электролитов в моче и расчет по формуле: Кмочи / Кмочи + Naмочи х 100. Значение выше 60% свидетельствует о недозаполнении (underfill) или гиповолемии. Это диктует необходимость инфузии 20% раствора альбумина в дозе 5 мл/кг с последующим введением фуросемида в дозе 1-4 мг/кг. Гиповолемический статус, приводящий к преренальному ОПП, также можно определить по экскретируемой фракции натрия (FENa+). по формуле: (Naмочи / Naплазмы) / (Креатининмочи / Креатининплазмы) х 100. Низкий показатель (менее 0.5 – 1.0), низкое АД подтверждают наличие гиповолемии.
4. Патогенетическая терапия. Спонтанные ремиссии при НС редки (5-6%). Лечение первого эпизода НС начинается с терапии ГКС по следующему стандарту [6,7]:
| Преднизолон 60 мг/м2/сут, максимально 60 мг/сут в течение 4-6 недель (индукционная терапия) |
| Преднизолон 40 мг/м2, максимально 40мг через день в течение 4-6 недель (поддерживающая терапия) |
| Ремиссия |
По последним рекомендациям KDIGO (2012) прием всей суточной дозы ПЗ осуществляется одномоментно утром. Обычно ответ на ГКС достаточно быстрый, в течение 2 недель. Данная терапия приводит к ремиссии по протеинурии более чем у 90% детей и менее чем у 50% взрослых. Терапия у взрослых более длительная – 5-6 месяцев, она может повысить частоту ремиссии, при этом индукционную дозу ГКС можно увеличить до 80 мг/с. Тем не менее, у большинства из них заболевание рецидивирует.
В зависимости от ответа на индукционную терапию ПЗ и дальнейшего течения используются следующие определения НС [KDIGO, 2012][6]:
1) первичный ответ – достижение полной ремиссии в течение 4 недель кортикостероидной терапии;
2) первичное отсутствие ответа – неспособность достичь полной ремиссии после 8 недель кортикостероидной терапии;
3) рецидив – оБ/К ≥2000мг/г (≥200мг/ммоль) или белок ≥3+ при определении тест-полосками в течение последовательных 3 дней;
4) редкие рецидивы – один рецидив в течение 6 месяцев после первичного ответа, или от 1 до 3 рецидивов в течение 12 месяцев;
5) частые рецидивы – 2 или более рецидивов в течение 6 месяцев после первичного ответа или 4 и более рецидивов в течение 12 месяцев;
6) стероид-зависимый НС (СЗНС) – 2 последовательных рецидива во время кортикостроидной терапии или в течение 14 дней после отмены;
7) позднее отсутствие ответа – персистирование протеинурии в течение 4 и более недель терапии кортикостероидами после предшествующего достижения одной или более ремиссий.
После 4-6-недельного поддерживающего (альтернирующего) курса в дозе 40 мг/м2/48 ч производится постепенное снижение дозы по 5-10 мг/м2 в неделю до полной отмены. Длительность ремиссии определяется продолжительностью курса терапии ПЗ, который должен составлять не менее 4-5 месяцев. Некоторые авторы (при редких рецидивах) отмену преднизолона проводят сразу после альтернирующего курса лечения.
Рецидивы СЧНС. Для своевременного выявления рецидива пациенты или их родители (если это ребенок) должны знать о необходимости контроля протеинурии с помощью тест-полосок, сначала через день, затем раз в неделю. Данные должны фиксироваться в дневнике. В случае инфекции или лихорадки проверять протеинурию следует ежедневно. Не менее важным является контроль массы тела пациента.
Часто рецидивирующий (ЧРНС) (>4 раза в год) и стероид-зависимый НС имеет место у 2/3 пациентов со СЧНС, представляя существенную терапевтическую проблему. Дети, заболевшие рано (в возрасте <3 лет), имеют больший риск частых рецидивов. У большинства пациентов чувствительность к ГКС сохраняется даже при последующих многочисленных рецидивах НС, в том числе – при редко встречающихся рецидивах во взрослом состоянии.
Дата добавления: 2017-10-04; просмотров: 2382;











