Критерий направленности химических реакций
Энтропия (S)– мера неупорядоченности системы, выражается через вероятность 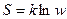 , где k – постоянная Больцмана, а w – количество микросостояний, с помощью которых можно реализовать данное макросостояние;
, где k – постоянная Больцмана, а w – количество микросостояний, с помощью которых можно реализовать данное макросостояние;
С другой стороны в равновесном процессе 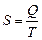 , а в неравновесном
, а в неравновесном 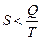 ; измеряется в Дж/К.
; измеряется в Дж/К.
Третье начало термодинамики (постулат Нернста) – энтропия идеального кристалла при абсолютном нуле (0 К) равна нулю.
Свободная энергия (энергия Гиббса, G)– функция состояния химической системы,включающая энтальпийный и энтропийный вклады. G ≡ H - T×S. Тогда 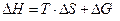 и ∆G – это часть энергии, которую можно превратить в работу, а T∆S – это рассеянное тепло (часть энергии, которую нельзя превратить в работу).
и ∆G – это часть энергии, которую можно превратить в работу, а T∆S – это рассеянное тепло (часть энергии, которую нельзя превратить в работу).
1. Нулевое начало термодинамики – две системы, находящиеся в термическом равновесии с третьей системой, состоят в термическом равновесии друг с другом: если Т1 = Т3 и Т2 = Т3, то Т1 = Т2.
2. Первое начало термодинамики– количество энергии, выделяющееся или поглощающееся в форме теплоты или работы равно изменению внутренней энергии: 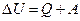
3. Второе начало термодинамики – в изолированной системе самопроизвольно могут протекать только процессы, приводящие к увеличению неупорядоченности системы, т.е. к росту энтропии (DS > 0)
4. Принцип Бертло-Томсена – в химической системе самопроизвольно протекают реакции, в результате которых выделяется тепло (∆Н < 0).
5. Принцип Гиббса– в любой химической системе при постоянном давлении и температуре возможен только такой самопроизвольный процесс, который ведет к уменьшению свободной энергии системы:
G→0, 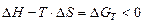
Вопросы и задачи к РАЗДЕЛУ
Термохимия
1. Тепловой эффект химической реакции, знак теплового эффекта, причины возникновения теплового эффекта.
2. Основные законы термохимии (Закон Лавуазье–Лапласса, закон Гесса).
3. Термохимический цикл. Энергия кристаллической решетки.
4. Какие характеристики ионов определяют энергию ионной кристаллической решетки?
5. В чем различие теплового эффекта и энтальпийного эффекта химической реакции? Могут ли они быть равны друг другу?
6. Стандартное состояние вещества.
7. Энтальпия фазовых превращений (плавления, испарения, сублимации).
8. Энтальпия атомизации и средняя энергия связи в многоатомной молекуле.
9. В чем различие между истинной и средней энергиями связи A–B в молекуле ABx?
10. Может ли энтальпия атомизации вещества быть экзотермической?
11. Энергетика химических реакций в организме. Гликолиз – основные стадии с позиций термохимии.
12. Использование термохимии в практической медицине: термостатирование, глубокое охлаждение, химические грелки.
13. АТФ – как источник энергии для жизнедеятельности организма.
14. Можно ли рассчитать изменение энтальпии в ходе таких химических реакций и таких фазовых переходов, которые практически не осуществимы в данных условиях?
15. Процесс протекает по схеме:
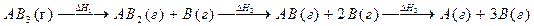
Справедливо ли для данного случая соотношение DH1=DH2=DH3? Можно ли эти значения энтальпий использовать для определения энергии связи A–B?
16. Напишите процессы образования 1 моля указанных веществ из простых веществ в стандартных состояниях (укажите эти состояния):
a) NaCl, CO, V2O3, Na2SO4, HNO3, H3PO4;
b) СuSO4·5H2O, Ca3(PO4)2, CaSiO3, (NH4)2CO3;
c) KF, NO, P2O5, HClO3, H2SO4, K3AlF6;
d) (NH4)2Cr2O7, KAl(SO4)2·12H2O, Mg(NO3)2, FeCl3.
17. Приведите примеры процессов атомизации элементов (простых веществ), гомоатомных молекул, бинарных соединений, кислород–содержащих кислот и их солей.
18. Пользуясь табличными данными для DH°f, рассчитайте изменения энтальпии в следующих реакциях:
a) H2O(г) + Br2(г) ¾® HBr(г) + O2(г);
b) NH3(г) + NO2(г) ¾® N2(г) + H2O(г);
c) N2(г) + H2O(ж) + O2(г) ¾® HNO3(ж).
19. Вычислите DH°f подчеркнутых веществ по данным об энтальпиях реакций (DH°f остальных веществ возьмите из справочника):
a) SiO2(кр) + CO(г) ¾® SiO(г) + CO2(г) DH° = +52,3 кДж/0,1 моль CO;
b) BaO(кр) + O2(г) ¾® BaO2(кр) DH° = –6,4 кДж/л O2.
20. Вычислите DH°f подчеркнутых веществ по данным об энтальпиях реакций (DH°f остальных веществ возьмите из справочника):
a). SnCl4(г) + HCl(г) + NH3(г) ¾® (NH4)2SnCl6(кр) DH° = –23,4 кДж/0,1 моль HCl;
b) NH3(г) + AlCl3(кр) ¾® AlN(кр) + HCl(г) DH° = +52,3 кДж/г AlN.
21. Определите DH° реакции COCl2(г) + 1/2O2(г) ¾® CO2(г) + Cl2(г)
по следующим данным:
COCl2(г) ¾® CO(г) + Cl2(г) DH° = +112,5 кДж
CO2(г) ¾® CO(г) + 1/2O2(г) DH° = +282,8 кДж
22. Определите DH° реакции HNO2(г) + 1/2O2(г) ¾® HNO3(г) по следующим данным:
1/2N2O4(г) ¾® NO2(г) DH° = +28,5 кДж
2NO2(г) + H2O(г) ¾® HNO2(г) + HNO3(г) DH° = –39,3 кДж
4HNO3(г) ¾® 2N2O4(г) + O2(г) + 2H2O(г) DH° = +77,0 кДж.
23. Определите DH° превращения твердой серы в двухатомные газообразные молекулы по следующим данным:
2H2(г) + S2(г) ¾® 2H2S(г) DH° = –167,2 кДж
2H2(г) + S(кр) ¾® 2H2S(г) DH° = –20,4 кДж.
24. Определите DH° реакции: CH3OH(ж) + H2(г) ¾® CH4(г) + H2O(г) исходя из энтальпий сгорания, которые равны:
CH3OH(г) –642,3 кДж
CH4(г) –802,7 кДж
H2(г) –242,0 кДж
Как изменится найденная величина DH°, если образуется не газообразная, а жидкая вода (энтальпия испарения воды 44,0 кДж/Моль)?
25. Энтальпия сгорания газообразного бензола с образованием углекислого газа и жидкой воды равна –3301,5 кДж/Моль. Рассчитайте энтальпию образования бензола из простых веществ.
26. Энтальпия сгорания мочевины с образованием жидкой воды равна –635 кДж/Моль. Рассчитайте энтальпию образования мочевины из простых веществ.
Дата добавления: 2021-09-07; просмотров: 510;











