Основные положения и понятия
Ø Большинство химических реакций сопровождаются тепловым эффектом (изменением энтальпии).
Энтальпия (H) – функция состояния, описывающая теплосодержание химической системы при постоянном давлении (теплосодержание расширяющейся системы): H ≡ U – pV, H ≡ Qp. Единицы измерения джоули (Дж) или калории (кал).
Изменение энтальпии реакции (DHр) – тепловой эффект химической реакции при постоянном давлении (изобарный процесс).
Ø По знаку величины изменения энтальпии (теплового эффекта) реакции различают экзотермические и эндотермические химические реакции.
Экзотермические реакции – в процессе реакции тепло выделяется во внешнюю среду (DH<0)
Эндотермические реакции – в процессе реакции тепло поглощается из внешней среды (DH>0)
Ø Химические реакции приводят не только к изменению природы реагирующих веществ, но и к изменению их внутренней энергии
Внутренняя энергия вещества (U) – все виды энергии, кроме потенциальной и кинетической энергии системы в целом.
Ø Стандартная энтальпия образования вещества (DH°f) – изменение энтальпии при образовании 1 моля сложного вещества из простых веществ, взятых при стандартных условиях в их наиболее устойчивых модификациях; измеряется в кДж/моль.
Стандартные условия – температура 25°С (298 К), давление 1 атм. (101 325 Па).
Ø Энтальпии образования простых веществ в стандартных условиях в их наиболее устойчивых модификациях приняты равными нулю.
Ø Стандартная энтальпия сгорания (DH°сг.) – изменение энтальпии при реакции сгорания 1 моля вещества в атмосфере кислорода при давлении 1 атм.
Ø Стандартная энтальпия атомизации (DH°ат)[2] – изменение энтальпии при образовании 1 моля газообразных атомов из простого вещества.
Законы и следствия
1. Закон Лавуазье-Лапласа
Тепловые эффекты химических реакций, протекающих в прямом и обратном направлении, равны по величине и противоположны по знаку.
H2 + Cl2 = 2HCl DH = – 184 кДж/моль
2HCl = H2 + Cl2 DH = +184 кДж/моль
2.
|
Тепловой эффект химической реакции зависит только от состояния исходных веществ и продуктов реакции и не зависит от числа промежуточных стадий, т.е. от пути протекания процесса
C(графит) + 1/2 O2 (г) = CO (г) DH°1
+
CO(г) + 1/2 O2 (г) = CO2 (г) DH°2
3. Следствия из закона Гесса
1. Теловой эффект кругового процесса равен нулю;
2. Изменение стандартной энтальпии химической реакции равно разности сумм стандартных энтальпий образования продуктов и стандартных энтальпий образования исходных веществ (с учетом количеств реагирующих веществ, т.е. стехиометрических коэффициентов).

3. Тепловой эффект реакции равен сумме теплот сгорания исходных веществ за вычетом суммы теплот сгорания продуктов, с учетом их стехиометрических коэффициентов.
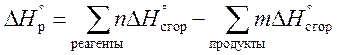
Дата добавления: 2021-09-07; просмотров: 379;











