Общие химические свойства оксидов
Оксиды могут участвовать в окислительно-восстановительных реакциях приводящих к изменению степени окисления данного элемента:
1°. Восстановление оксидов. Восстановители (C, CO, H2 , CH4 , и др., активные металлы, такие как Mg, Al) при нагревании восстанавливают многие элементы из оксидов до простых веществ:
ZnO + C  Zn + CO
Zn + CO
WO3 + 3 H2 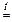 W + 3 H2O
W + 3 H2O
3 CuO + 2 NH3 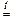 3 Cu + N2 + 3 H2O
3 Cu + N2 + 3 H2O
P4O10 + 10 C  P4 + 10 CO
P4 + 10 CO
9 CuO + 2 CH3NH2 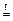 9 Cu + N2 + 2 CO2+ 5 H2O
9 Cu + N2 + 2 CO2+ 5 H2O
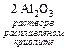
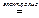 4 Al + 3 O2
4 Al + 3 O2
CuO + CO 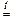 Cu + CO2
Cu + CO2
Cr2O3 + 2 Al  2 Cr + Al2O3
2 Cr + Al2O3
SiO2 + 2 Mg 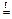 Si + 2 MgO
Si + 2 MgO
2 NO2 + 4 Cu  2 N2 + 4 CuO
2 N2 + 4 CuO
CO2 + 2 Mg  C + 2 MgO.
C + 2 MgO.
2°. Окисление оксидов. Оксиды элементов, проявляющих переменные степени окисления, могут участвовать в реакциях, приводящих к повышению степени окисления данного элемента:
 + 4 NaOH + 3 NaNO3
+ 4 NaOH + 3 NaNO3 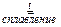 2
2 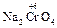 + 3 NaNO2 + 2 H2O
+ 3 NaNO2 + 2 H2O
3 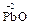 + KClO3
+ KClO3 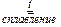 3
3 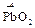 + KCl
+ KCl
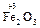 + 4 KOH + 3 KNO3
+ 4 KOH + 3 KNO3 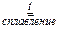 3 KNO2 + 2
3 KNO2 + 2 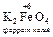 + 2 H2O
+ 2 H2O
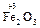 + 3 Cl2 + 10 KOHконц.
+ 3 Cl2 + 10 KOHконц. 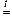 2
2  + 6 KCl + 5 H2O
+ 6 KCl + 5 H2O
2 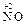 + O2 = 2
+ O2 = 2 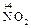
2 NO2 + O3 =  + O2.
+ O2.
3°. Пассивация оксидов. Термическое разложение гидроксидов при высоких температурах (> 1000°C) приводит к получению оксидов в химически малоактивной форме. Оксиды полученные таким путем не растворяются ни в кислотах, ни в щелочах. Перевести их в растворимое состояние можно только лишь сплавлением с кислыми солями или щелочами. Примером могут служить оксиды алюминия, хрома, титана.
Глава 2
Дата добавления: 2021-09-07; просмотров: 441;











