Способы получения оксидов
Оксиды могут быть получены в результате различных химических реакций.
1°. При взаимодействии простых веществ (за исключением золота, платины и инертных газов) с кислородом:
S + O2 = SO2,
2 Ca + O2 = 2 CaO,
4 Li + O2 = 2 Li2O.
При горении других щелочных металлов в кислороде образуются пероксиды:
2 Na + O2 = Na2O2
или надпероксиды:
K + O2 = KO2.
Оксиды этих металлов могут быть получены при взаимодействии пероксида (или надпероксида) с соответствующим металлом:
Na2O2 + 2 Na 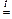 2 Na2O
2 Na2O
или при термическом их разложении:
2 BaO2 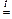 2 BaO + O2.
2 BaO + O2.
2°. В результате горения бинарных соединений в кислороде:
а) обжиг халькогенидов:
4 FeS2 + 11 O2 = 2 Fe2O3 + 8 SO2
2 CuSe + 3 O2 = 2 CuO + 2 SeO2
4 CuFeS2 + 13 O2 = 4 CuO + 2 Fe2O3 + 8 SO2
б) горение гидридов и фосфидов.
4 PH3 + 8 O2 = P4O10 + 6 H2O Þ 4 H3PO4
CS2 + 3 O2 = CO2 + 2 SO2
2 Сa3P2 + 8 O2 = 6 CaO + P4O10.
3°. При термическом разложении солей:
a) карбонатов:
CaCO3 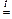 CaO + CO2.
CaO + CO2.
Карбонаты щелочных металлов (за исключением карбоната лития) плавятся без разложения.
б) нитратов:
2 Cu(NO3)2  2 CuO + 4 NO2 + O2.
2 CuO + 4 NO2 + O2.
в) Если соль образована катионом металла, проявляющим переменные степени окисления и анионом кислоты, обладающей окислительными свойствами, то могут образоваться оксиды с другими степенями окисления элементов, например,
4 Fe(NO3)2  2 Fe2O3 + 8 NO2 + O2
2 Fe2O3 + 8 NO2 + O2
2 FeSO4 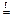 Fe2O3 + SO2 + SO3
Fe2O3 + SO2 + SO3
(NH4)2Cr2O7  N2 + 4 H2O + Cr2O3.
N2 + 4 H2O + Cr2O3.
4°. Термическое разложение оснований и кислородсодержащих кислот приводит к образованию оксида и воды:
H2SO3  SO2 + H2O
SO2 + H2O
SiO2 × x H2O 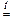 SiO2 + x H2O
SiO2 + x H2O
Ca(OH)2 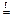 CaO + H2O.
CaO + H2O.
Гидроксиды щелочных металлов плавятся без разложения.
5°. Если химический элемент в своих соединениях проявляет различные степени окисления и образует несколько оксидов, то:
а) при окислении низших оксидов можно получить оксиды, в которых соответствующий элемент находится в более высокой степени окисления:
4 FeO + O2 = 2 Fe2O3
2 NO + O2 = 2 NO2
2 NO2 + O3 = N2O5 + O2
2 SO2 + O2 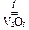 2 SO3,
2 SO3,
б) и, аналогично, при восстановлении высших оксидов можно получить низшие оксиды:
Fe2O3 + CO  2 FeO + CO2.
2 FeO + CO2.
6°. Некоторые металлы, стоящие в ряду напряжений до водорода, могут при высокой температуре вытеснять водород из воды. При этом также образуется оксид металла:
Fe + H2O 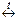 FeO + H2 (t > 570°C).
FeO + H2 (t > 570°C).
7°. При нагревании солей с кислотными оксидами. Направление реакции в этом случае зависит от относительной летучести оксидов — менее летучий оксид вытесняет более летучий оксид из соли:
Na2CO3 + SiO2  Na2SiO3 + CO2
Na2SiO3 + CO2
2 Ca3(PO4)2 + 6 SiO2  6 CaSiO3 + P4O10
6 CaSiO3 + P4O10
2Na2SO4 + 2B2O3 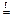 4NaBO2 + 2SO2 + O2
4NaBO2 + 2SO2 + O2
4 NaNO3 + 2 Al2O3 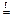 4 NaAlO2 + 4 NO2 + O2.
4 NaAlO2 + 4 NO2 + O2.
8°. При взаимодействии металлов с кислотами-окислителями происходит частичное восстановление кислотообразующего элемента с образованием оксида:
Cu + 2 H2SO4, конц. = CuSO4 + SO2 + 2 H2O
Zn + 4 HNO3, конц. = Zn(NO3)2 + 2 NO2 + 2 H2O.
9°. При действии водоотнимающих веществ на кислоты или соли:
4 HNO3 + P4O10 = (HPO3)4 + 2 N2O5
2 KMnO4 + H2SO4, конц. = K2SO4 + Mn2O7 + H2O
2 KClO4 + H2SO4, конц. = K2SO4 + Cl2O7 + H2O.
10°. При взаимодействии солей слабых неустойчивых кислот с растворами сильных кислот:
Na2CO3 + 2 HCl = 2 NaCl + CO2 + H2O.
Дата добавления: 2021-09-07; просмотров: 409;











