Протолитическая теория
Датский физико-химик Йоханнес Бренстед (1879 – 1947 гг.) и английский химик Томас Лоури (1874 – 1936 гг.) практически одновременно (1928 – 1929 гг.) предложили протолитическую теорию кислот и оснований, согласно которой
кислота — донор катионов водорода:
HAn « H+ + An–
Кислоты могут быть:
а) молекулярными HCl « H + + Cl –
б) катионными 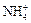 « NH3 + H +
« NH3 + H +
в) анионными  «
« 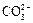 + H +
+ H +
Основание — акцептор катионов водорода.
Основания делятся на
а) молекулярные NH3 + H + « 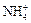
б) анионные OH – + H + « H2O
в) катионные AlOH2+ + H+ « Al3+ + H2O
Амфотерные вещества (амфолиты) — это вещества, которые являются как донорами, так и акцепторами протонов. Они могут быть заряженными, например:
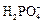 « H + +
« H + + 
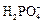 + H + « H3PO4
+ H + « H3PO4
и нейтральными:
H2O « H + + OH –
H2O + H + « H3O+.
Кислоты и основания существуют только как сопряженные пары:
кислота « основание + протон
Кислотно-основной процесс сопряженных кислот и оснований может быть выражен общей схемой:
AH + B « BH+ + A–,
где AH, BH+ — кислоты B, A– — основания.
Протон не существует в растворе в свободном виде, в воде он образует катион гидроксония H3O+.
Понятия кислоты в протолитической и электролитической теориях совпадают, однако понятие «основание» охватывает более широкий круг соединений: основаниями могут быть вещества, которые не имеют анионов ОН –, например, NH3 , (C2H5)2O.
Электронная теория
В 1926 г. американский физико-химик Гилберт Льюис (1875 – 1946 гг.) предложил электронную теорию кислот и оснований.
По его теории к кислотам относятся вещества, являющиеся акцепторами электронной пары, а к основаниям — донорами электронной пары
Отличительным признаком этой теории является то, что кислота и основание взаимодействуют друг с другом с образованием связи по донорно-акцепторному механизму:
A + : B « A : B,
где – A — кислота,:B — основание, A : B — кислотно-основный комплекс (продукт нейтрализации).
В результате приобретения атомом, ответственным за кислотные свойства, электронной пары часто возникает завершенная электронная конфигурация. В отличие от электролитической и протолитической теорий, к кислотам относят соединения, не содержащие водород (апротонные кислоты).
Например:
: NH3 + – BF3 « NH3BF3,
– BF3 является кислотой.
Таблица 4
Некоторые примеры “реакций нейтрализации”
| Кислота | Основание | Кислотно-основный комплекс |
| H+ | OH– | H2O |
| CO2 | H2O | H2CO3 |
| AlCl3 | Cl– | [AlCl4]– |
| Zn(OH)2 | 2OH– | [Zn(OH)4]– |
| BF3 | NH3 | BF3 × NH3 |
| BF3 | (C2H5)2O | (C2H5)O × BF3 |
| SbCl5 | (C2H5)2O | SbCl5 × (C2H5)2O |
| Ag+ | 2CN | [Ag(CN)2]+ |
Понятия основания в теориях Бренстеда (протолитическая теория) и Льюиса совпадают, однако понятие кислоты в электронной теории охватывает, кроме протона, более широкий круг частиц способных акцептировать электронную пару.
Растворение кислот Льюиса в ионизирующих растворителях (например, в H2O) приводит к росту концентрации ионов водорода (катионов гидроксония):
AlCl3 + 2 H2O « Al(OH)Cl2 + H3O+ + Cl –
SO3 + 2 H2O « H3O+ + 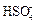 .
.
Растворение оснований Льюиса в воде приводит к увеличению концентрации анионов OH– :
NH3 + H2O « 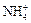 + OH –
+ OH –
(CH3)NH2 + H2O « (CH3) 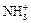 + OH –.
+ OH –.
Кислотные свойства ортоборной кислоты H3BO3 обусловлены не электролитической диссоциацией этого соединения, а образованием катионов гидроксония (H3O+) по реакции:
H3BO3 + 2 H2O « [B(OH)4] – + H3O+.
Кислоты
Дата добавления: 2021-09-07; просмотров: 483;











