Химические свойства оксидов
Основные оксиды
К основным оксидам относятся:
– оксиды всех металлов главной подгруппы первой группы (щелочные металлы Li – Fr),
– главной подгруппы второй группы, начиная с магния (Mg – Ra) и
– оксиды переходных металлов в низших степенях окисления, например, MnO, FeO.
1°. Оксиды наиболее активных металлов (щелочных и щелочноземельных, начиная с кальция) при обычных условиях непосредственно взаимодействуют с водой, образуя гидроксиды, которые являются сильными, растворимыми в воде основаниями — щелочами, например,
BaO + H2O = Ba(OH)2;
Na2O + H2O = 2 NaOH.
2°. Основные оксиды взаимодействуют с кислотами образуя соли:
CaO + 2 HCl = CaCl2 + H2O.
3°. Также к образованию соли приводит взаимодействие их с кислотными оксидами:
Na2O(тв.) + СO2(газ) = Na2CO3
CaO(тв.) + SO3(ж.) = CaSO4
СaO(тв.) + SiO2(тв.) 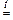 CaSiO3.
CaSiO3.
Кислотные оксиды
Большинство оксидов неметаллов являются кислотными оксидами (СО2 , SO3 , P4O10 и др.). Оксиды переходных металлов в высших степенях окисления проявляют преимущественно также свойства кислотных оксидов, например: CrO3 , Mn2O7 , V2O5 .
1°. Кислотные оксиды реагируют с водой с образованием соответствующих кислот:
SO3 + H2O = H2SO4
P4O10 + 6 H2O = 4 H3PO4.
Некоторые оксиды, например, SiO2 , MoO3 и др. с водой непосредственно не взаимодействуют и соответствующие им кислоты могут быть получены косвенным путем:
(x – 1) H2O + Na2SiO3 + 2 HCl = 2 NaCl + SiO2 × x H2O ¯
Na2MoO4 + 2 HCl = 2 NaCl + H2MoO4 ¯.
2°. Взаимодействие кислотных оксидов с основными оксидами приводит к образованию солей:
SO2 + Na2O = Na2SO3
SiO2 + CaO 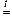 CaSiO3.
CaSiO3.
3°. Также к образованию солей ведет реакция кислотного оксида с основанием.
Cl2O + 2 NaOH = 2 NaClO + H2O.
Если кислотный оксид является ангидридом многоосновной кислоты, то в зависимости от относительных количеств основания и кислотного оксида, участвующих в реакции, возможно образование средних
Ca(OH)2 + CO2 = CaCO3 ¯ + H2O.
или кислых солей
CaCO3 ¯ + H2O + CO2 = Ca(HCO3)2 р-р.
4°. Мало летучие оксиды вытесняют летучие оксиды из солей:
Na2CO3 + SiO2 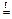 Na2SiO3 + CO2.
Na2SiO3 + CO2.
Амфотерные оксиды
Амфотерность (от греч. amphoteros — и тот и другой) — способность химических соединений (оксидов, гидроксидов, аминокислот) проявлять как кислотные, так и основные свойства, в зависимости от свойств второго реагента, участвующего в реакции.
Одно и то же вещество (например, ZnO), реагируя с сильной кислотой или кислотным оксидом, проявляет свойства основного оксида:
ZnO + 2 HCl = ZnCl2 + H2O
ZnO + SO3 = ZnSO4.
а при взаимодействии с сильным основанием или основным оксидом – свойства кислотного оксида:
ZnO + 2 NaOH + H2O = Na2[Zn(OH)4] (в водном растворе)
ZnO + CaO 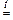 CaZnO2 (при сплавлении).
CaZnO2 (при сплавлении).
Амфотерные оксиды способны вытеснять летучие оксиды из солей:
K2CO3 + ZnO  K2ZnO2 + CO2.
K2ZnO2 + CO2.
Дата добавления: 2021-09-07; просмотров: 441;











