Способы расчета стандартной энтальпии химической реакции
1) По стандартным энтальпиям (теплотам) образования веществ
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па.
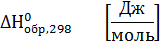
Теплоты образования простых веществ равны нулю.
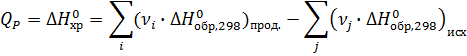
νi , νj – стехиометрические коэффициенты перед соответствующими веществами в уравнении реакции.
2) По стандартным энтальпиям (теплотам) сгорания веществ
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
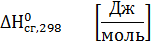
Теплоты сгорания высших оксидов (в том числе СО2 и Н2О) приняты равными нулю.
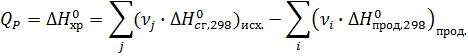
Второй закон термодинамики устанавливает возможность, направление и глубину протекания самопроизвольного процесса.
Самопроизвольный процесс - процесс, протекающий без каких-либо воздействий извне, и приближающий систему к состоянию равновесия.
Термодинамически обратимый процесс– процесс, протекающий в прямом и в обратном направлении без изменений в системе и в окружающей среде, т.е. при переходе из начального состояния в конечное все промежуточные состояния являются равновесными.
При наличии неравновесных промежуточных состояний процесс считаюттермодинамически необратимым.
В природе устойчивы системы, обладающие минимальной энергией. Тогда самопроизвольными должны быть лишь экзотермические процессы. Но это не так. Значит, имеется другой критерий самопроизвольного протекания процесса – энтропия (S).
Энтропия - мера энергетического беспорядка в системе, мера хаоса, мера той энергии, которая рассеивается в виде тепла и не превращается в работу.
Второй закон термодинамики (второе начало термодинамики):
Самопроизвольно протекают процессы, приводящие к увеличению общей энтропии системы и окружающей среды
ΔSсист + ΔSсреды ≥ 0  или ΔS ≥ 0
или ΔS ≥ 0
Физический смысл энтропии:
энтропия – это количество энергии, рассеянной 1 моль вещества, отнесенное к 1 градусу.
S 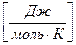
Энтропия – экстенсивная функция. Энтропия пропорциональна массе, её относят к 1 моль или 1 грамму вещества. Это означает, что энтропия системы равна сумме энтропий составных частей:
S = 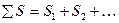
Энтропия является функцией состояния системы. Это значит, что 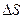 характеризует систему,а не процесс. Её изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода:
характеризует систему,а не процесс. Её изменение зависит только от начального и конечного состояния системы и не зависит от пути перехода:
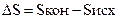 .
.
Для химической реакции изменение энтропии: 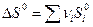 прод -
прод - 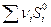 исх
исх
Дата добавления: 2021-09-07; просмотров: 555;











