Химическая кинетика
Приложение 2:Краткий теоретический материал
Химическая кинетика изучает закономерности протекания химических процессов во времени.
Основные понятия кинетики:
Скорость реакции – это изменение концентрации реагирующих веществ в единицу времени:
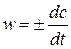 .
.
Поскольку скорость реакции - величина положительная, то “+” ставится, если используется концентрация продуктов реакции, и “-” - для исходных веществ.
Например, для реакции 3H2+N2 = 2NH3.
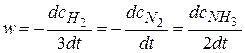 .
.
Общая скорость реакции равна скорости реакции по отдельному веществу, деленная на стехиометрический коэффициент, стоящий перед этим веществом в уравнении химической реакции.
Существует понятие средней и истинной скорости реакции.
Средняя скорость в интервале – изменение концентрации реагирующих веществ за некоторый промежуток времени:
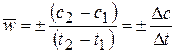 ,
,
Средняя скорость относится к средней концентрации 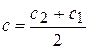
Истинная скорость – изменение концентрации реагирующих веществ в конкретный момент времени и представляет собой предел средней скорости при Dt®0
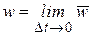 ,
,
Различают простые и сложные реакции.
Простыми называют реакции, протекающие в одну стадию.
Сложными называют реакции, протекающие в несколько стадий.
Выделяют следующие виды сложных реакций:
1) параллельные;
2) последовательные,
3) сопряженные;
4) цепные.
Основной постулат химической кинетики– закон действующих масс
w= 
Скорость реакции пропорциональна произведению концентрации реагирующих веществ, взятых в некоторых степенях. Эти степени называются частными порядками реакции:
p - частный порядок реакции по веществу А,
q - частный порядок реакции по веществу В.
Сумма частных порядков дает полный порядок реакции n: n=p+q.
k - константа скорости реакции, это скорость реакции при концентрации реагирующих веществ, равных единице (удельная скорость).
Молекулярность реакции - число молекул, реагирующих в одном элементарном акте реакции.
Для реакций различных порядков зависимость скорости от концентрации реагирующих веществ выражается индивидуальным кинетическим уравнением.
1) Реакции нулевого порядка (n=0).
Вид реакции: A®продукт; в этом случае скорость реакции не зависит от концентрации исходного вещества, т.е. концентрация вещества А поддерживается на одном уровне.
Кинетическое уравнение: 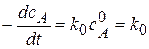 . или
. или
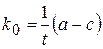 ,
,
где k0 – константа скорости реакции нулевого порядка;
t – время от начала реакции до достижения концентрации с;
а - концентрация вещества А при t=0,
с - концентрация вещества А в момент времени t .
Размерность k0 определяется выражением k0=w, поэтому 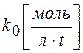 .
.
Время полупревращения t1/2 - время, за которое концентрация исходного вещества уменьшается в 2 раза.
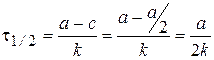 .
.
2) Реакции первого порядка ( n=1).
Вид реакции: A®продукт;
Кинетическое уравнение: 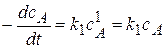 или
или 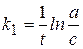 ,
,
Размерность константы скорости: k1, [t-1].
Время полупревращения t1/2: 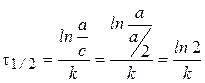 .
.
3) Реакции второго порядка ( n=2).
Вид реакции: A+В®продукт или 2A ®продукт.
Пусть к началу реакциии концентрации исходных веществ равны 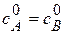 .
.
Кинетическое уравнение: 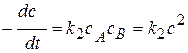 или
или 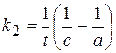 .
.
Размерность константы скорости: k2, [конц.-1× t-1].
Время полупревращения t1/2: 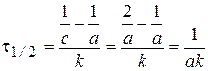 .
.
Размерность константы скорости: k3, [конц.-2× t-1].
В общем случае 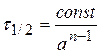 .
.
Экспериментально скорость реакции определяют измерением концентрации реагирующих веществ за определенный промежуток времени с последующим расчетом по формулам средней или истинной скорости реакции.
Константу скорости реакции можно определить представив экспериментальные данные в линейных координатах кинетического уравнения соответствующего порядка.
Дата добавления: 2021-09-07; просмотров: 578;











