Понятие о теории активных соударений.
Для того чтобы произошла химическая реакция, необходимо, чтобы частицы столкнулись. Скорость реакции пропорциональна общему числу двойных столкновений в единицу времени в единице объема
w=qzобщ,
где q – коэффициент пропорциональности.
В теории соударений используются следующие допущения:
1. Частицы бесструктурны – это шары с радиусом r;
2. В момент соударения молекулы ведут себя как упругие шары. Т.е. суммарная энергия молекул до и после соударения остается постоянной, но может перераспределяться между молекулами.
3. Реагируют только молекулы, которые обладают энергией активации.
4. Число двойных активных столкновений определяется соотношением:
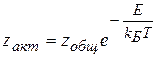 ,
,
где zобщ – общее число столкновений,
zакт – число активных столкновений,
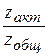 - доля активных столкновений, равная множителю Больцмана
- доля активных столкновений, равная множителю Больцмана 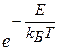 . Он тем меньше, чем больше энергия активации.
. Он тем меньше, чем больше энергия активации.
5. Процесс превращения исходных веществ в продукты происходит мгновенно в момент соударения активных молекул.
6. Скорость реакции А+В=С определяется выражением
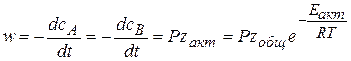 ,
,
где Р – стерический фактор.
Он определяется опытным путем из соотношения опытной и теоретической скорости. Р<1.
Роль стерического фактора:
Стерический фактор характеризует вероятность реакции между молекулами, энергия которых 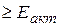 и учитывает необходимость определенной ориентации реакционноспособных молекул в момент столкновения.
и учитывает необходимость определенной ориентации реакционноспособных молекул в момент столкновения.
Сравнивая два выражения для скорости реакции, получаем уравнение:
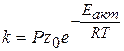 ,
,
совпадающее с уравнением Аррениуса
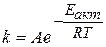 ,
,
откуда предэкспоненциальный множитель А=Рz0.
Общее число всех двойных соударений в секунду в единице объема равно:
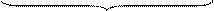
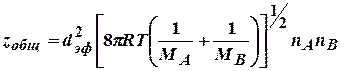 ,
,
z0
где: МА и МВ – молярные массы веществ А и В,
dэф.- эффективный диаметр столкновений, равный в общем случае rA+rB;
при межмолекулярном отталкивании dэф< rA+rB;
при межмолекулярном притяжении dэф> rA+rB.
По теории соударений можно рассчитать константу скорости реакции k, зная размеры и молекулярные массы частиц.
Недостатки теории активных соударений.
1) бесструктурность частиц – они рассматриваются как шары
2) элементарный акт рассматривается как мгновенный, в действительности это сложный процесс перераспределения связей, требующий определенного времени.
Теория активных соударений объясняет много разнообразных факторов, но не объясняет влияния на скорость реакции растворителя, давления, добавок инертных газов, не позволяет сделать теоретическую оценку стерического фактора.
Понятие о теории активированного комплекса (переходного состояния)
Теория основывается на квантовых представлениях о строении молекул и химической связи. Она должна решить следующие задачи:
1) рассмотреть энергетику взаимодействия реагирующих частиц с целью определения энергии активации;
2) рассчитать константы скорости химической реакции при известной энергии активации.
Рассмотрим бимолекулярную реакцию
AB + C → BC + A.
Считается, что частицы уже активированы, т.е. рассматриваем сам элементарный акт реакции, происходящий во времени.
При сближении активированных молекул взаимодействие между ними начинается еще до столкновения – старая связь ослабевает, но еще не разрушена, при этом одновременно образуется новая связь. Таким образом, образуется трехатомный конгломерат (активированный комплекс), который находится в равновесии с исходными веществами и затем распадается на продукты.
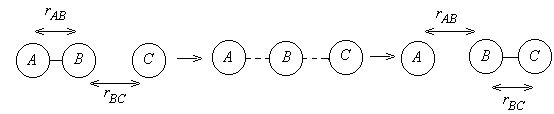
Активированный комплекс находится в равновесии с исходными веществами:
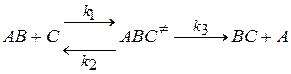
или, в более общем виде:
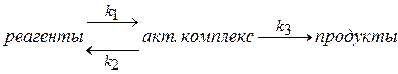
так что можно записать 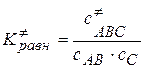 . Активированный комплекс устойчив во всех направлениях, кроме пути реакции. Т.е. активированный комплекс может распасться только на продукты реакции.
. Активированный комплекс устойчив во всех направлениях, кроме пути реакции. Т.е. активированный комплекс может распасться только на продукты реакции.
Путь или координата реакции – это взаимосвязанное изменение совокупности межъядерных расстояний при переходе от начальной конфигурации атомов к конечной, сопровождающееся минимальным изменением потенциальной энергии. Сечение поверхности потенциальной энергии вдоль пути реакции называется профилем пути реакции (рис. 4).
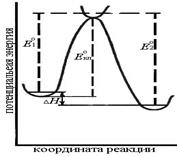
Рис. 4. Энергетический профиль вдоль координаты реакции
Из хода кривой видно, что в процессе элементарного акта химического превращения система должна преодолеть потенциальный барьер, равный энергии активации. Истинная энергия активации 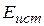 представляет собой разность энергий активированного комплекса и исходных молекул, отсчитанных от нулевого колебательного уровня. Ее обозначают
представляет собой разность энергий активированного комплекса и исходных молекул, отсчитанных от нулевого колебательного уровня. Ее обозначают 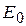 . Область состояния вблизи потенциального барьера можно рассматривать как переходное состояние. Для большинства элементарных реакций система, достигнувшая области переходного состояния, неизбежно перейдет в конечное состояние, т.е. перевалит через барьер.
. Область состояния вблизи потенциального барьера можно рассматривать как переходное состояние. Для большинства элементарных реакций система, достигнувшая области переходного состояния, неизбежно перейдет в конечное состояние, т.е. перевалит через барьер.
Для определения 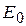 необходимо построить поверхность потенциальной энергии U(q), т.е. знать зависимость потенциальной энергии от координаты реакции. Для этого необходимо решить уравнение Шредингера, что возможно только для простейших систем.
необходимо построить поверхность потенциальной энергии U(q), т.е. знать зависимость потенциальной энергии от координаты реакции. Для этого необходимо решить уравнение Шредингера, что возможно только для простейших систем.
Расчет константы скорости элементарной реакции при заданной энергии активации основан на постулатах:
1. Распределение молекул по энергиям и скоростям подчиняется распределению Максвелла-Больцмана. Превращение активных комплексов в продукты реакции не нарушает этого распределения, т.е. доля активных частиц в ходе реакции не изменяется, и поэтому концентрацию активных комплексов можно вычислить из распределения Максвелла-Больцмана.
2. Реакция протекает адиабатически. Адиабатическое приближение состоит в том, что система взаимодействующих атомов делится на две подсистемы – медленную подсистему ядер и быструю подсистему электронов, которая успевает быстро, безынерционно перестроиться при изменении конфигурации ядер. Поэтому можно рассматривать только одну поверхность потенциальной энергии для ядер, которые и должны преодолеть энергетический барьер в ходе реакции.
3. Активированный комплекс находится в равновесии с исходными веществами
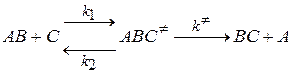 .
.
Скорость реакции определяется лимитирующей стадией – распадом активированного комплекса. Её можно определить либо по закону действующих масс
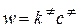 ,
,
либо как число активных комплексов, прореагировавших в единицу времени 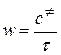 ,
,
где 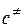 - концентрация активированных комплексов, а τ – время жизни активированного комплекса.
- концентрация активированных комплексов, а τ – время жизни активированного комплекса.
. 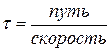
Активированный комплекс существует не при определенном значении межъядерных расстояний, а в каком-то интервале δ, следовательно, время жизни комплекса
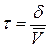 ,
,
где 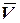 - средняя скорость движения активированного комплекса через вершину энергетического барьера (одномерная скорость).
- средняя скорость движения активированного комплекса через вершину энергетического барьера (одномерная скорость).
Используя приведенные выражения для средней скорости движения активного комплекса и аппарат статистической термодинамики, получаем следующее выражение для константы скорости:
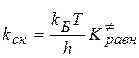 ,
,
где 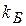 - постоянная Больцмана,
- постоянная Больцмана,
h – постоянная Планка
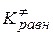 - константа равновесия активированного комплекса, которая равна
- константа равновесия активированного комплекса, которая равна 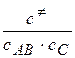 .
.
В тех случаях, когда адиабатическое приближение не выполняется, и электронная подсистема преодолевает свой энергетический барьер, в выражение для kск вносят трансмиссионный множитель 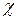 , он меньше единицы:
, он меньше единицы:
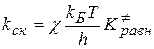 .
.
Физический смысл трансмиссионного коэффициента состоит в том, что не всегда образованный активированный комплекс разваливается с образованием продуктов реакции, существует вероятность образования из него исходных веществ. При χ=1 эффективность развала АК в продукты составляет 100%.
При термодинамическом подходе константу равновесия выражают через разность термодинамических функций активированного комплекса и исходных веществ.
Для бимолекулярной реакции в растворе константу равновесия выражают через функцию Гельмгольца образования активированного комплекса:
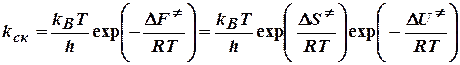 .
.
Для бимолекулярной реакции в газовой фазе в формулу добавляется множитель RT/p0, необходимый для перехода от 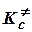 к
к 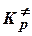 :
:
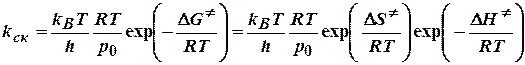 .
.
Энтропийный множитель иногда интерпретируют как стерический фактор Р из теории активных соударений.
Серьезным недостатком теории переходного состояния является отсутствие экспериментальных данных о строении активированного комплекса, что затрудняет ее применение. Несмотря на это, благодаря сравнительной простоте математического аппарата она является наиболее широко используемой теорией кинетики элементарных химических реакций, позволяет правильно объяснить и полуколичественно предсказать много закономерностей для кинетики химических реакций.
Катализ
Явление катализа –это изменение скорости реакции под действием некоторых веществ, которые к концу реакции остаются в химически неизменном виде.
Разновидности катализа:
1) положительный – под действием некоторых веществ скорость реакции увеличивается;
2) отрицательный: под действием некоторых веществ скорость реакции уменьшается, такие вещества называются ингибиторами;
3) автокатализ: катализатором являются продукты реакции;
4) гомогенный: катализатор и реагенты находятся в одной фазе (газ или раствор);
5) гетерогенный: катализатор и реагенты находятся в разных фазах;
6) ферментативный: катализатором является биологический фермент.
Принципы катализа:
1) катализатор принимает участие в химической реакции, образуя промежуточные продукты, но в конце реакции выделяется в химически неизменном виде. Физическое состояние катализатора, входящего в активный комплекс, может существенно изменяться, например, уменьшатся размеры зерен твердого катализатора, изменится структура поверхностных слоев;
2) катализатор не смещает положение равновесия, а лишь увеличивает скорость прямой и обратной реакции в равной степени;
3) действие катализатора является специфичным (селективным);
4) катализатор увеличивает скорость реакции за счет уменьшения Еакт, ведет реакцию по пути с меньшим энергетическим барьером.
Гомогенный катализ
Рассмотрим схему реакции, протекающей без катализатора:
A + B → AB* →C + D.
В присутствии катализатора реакция протекает в несколько стадий:
1. 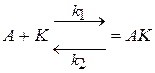
2. 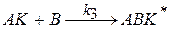
3. 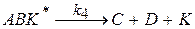
При условии k3>>k1 скорость образования продуктов можно выразить через концентрации реагентов и катализатора:
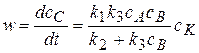
Это уравнение лежит в основе кинетики гомогенных каталитических реакций. Из уравнения видно, что скорость процесса прямо пропорциональна концентрации катализатора, исключение составляют лишь случаи, когда катализатор находится в большом избытке, в результате чего скорость процесса лимитируется не кинетическими, а физическими закономерностями, например, диффузией растворенного вещества к катализатору.
Энергетический профиль каталитической реакции представлен на рисунке 4.
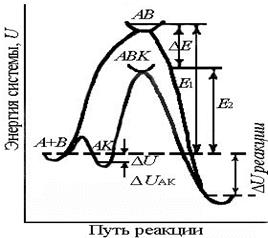
Рис.4. Энергетические профили
реакций с катализатором и без него.
Е1 – энергия активации некаталитической реакции,
Е2 – каталитической реакции
В ранних исследованиях предполагалось, что поверхность катализатора энергетически однородна (Лэнгмюр). В дальнейшем была экспериментально доказана адсорбционная неоднородность поверхности. Возникло представление о том, что каталитически активны только определенные участки поверхности, на которых имеются адсорбционные центры. Здесь вещество способно образовать активное для протекания данного каталитического процесса промежуточное поверхностное соединения, благодаря чему понижается энергия активации реакции.
Дата добавления: 2021-09-07; просмотров: 1264;











