П. Реакции бензольного ядра
1. Электрофилъное замещениеводородов ядра фенолов идет легко, в более мягких условиях, чем для бензола - фенольный гидроксил является одним из сильных (орто-пара)-ориентантов (электронодоноров). а) Бромная вода, реагируя с фенолом, дает осадок 2,4.6-трибромфенола. Хлор в среде СС14 образует смесь орто- и пара-хлорфенолов:
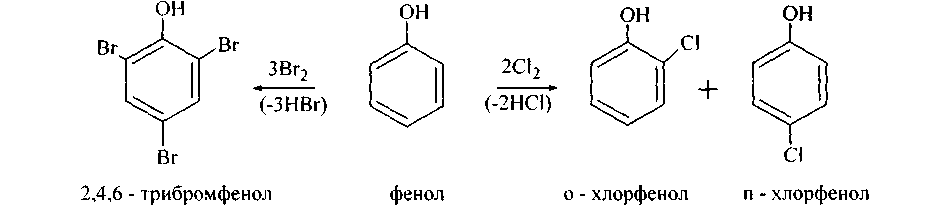
Хлорирование фенолов без растворителя при температуре от 40ºС до155°С дает смесь о- и п-хлорфенолов с преобладанием п-изомера, а в растворе СС14 при низкой температуре о-изомер получается с выходом 66%. Бромирование в среде CS2 при 5°С приводит почти исключительно к п-изомеру (80 - 84%). При более высокой температуре образуется в заметных количествах и о-бромфенол. Если же взять достаточное количество хлора или брома в растворителе или без него, фенол превращается в 2,4,6-тригалогенпроизводное.
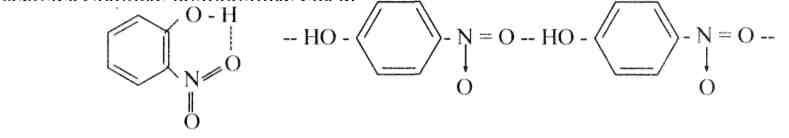
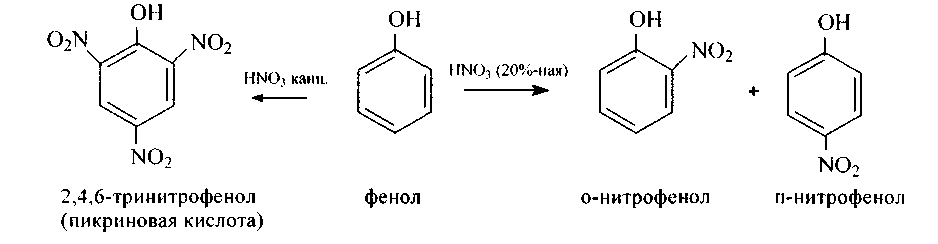
б) Действие разбавленной азотной кислоты при комнатной температуре приводит к смеси о- и п-нитрофенолов (с преобладанием первого), легко разделяемой при перегонке с водяным паром. Орто-изомер более летуч легко отгоняется), как соединение с внутримолекулярной водородной связью, а пара-изомер, как известно, имеет межмолекулярные водородные связи:
Концентрированный раствор азотной кислоты нитрует фенол до 2,4,6-тринитрофенола, или пикриновой кислоты:
93. Приведите уравнения и механизм следующих реакций и назовите продукты:
а) фенол + бромная вода; д) м-крезол + хлор (в СС14);
б) фенол + хлор (избыток); е) о-крезол + HNO3 (разбавл.)
в) фенол + HNO3 (разбавл.); ж) фенол+ HN03 (концентр.);
г) п-крезол + хлор (в СС14); з) м-крезол + HN03 (разбавл.)
в) Сульфирование фенола при комнатной температуре дает о-фенолсульфокислоту. а при более высокой температуре - п-изомер:
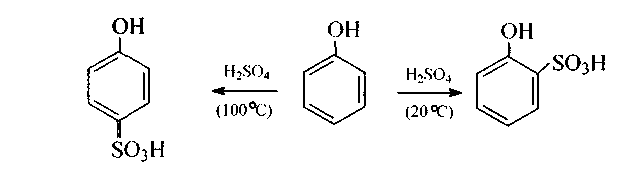
В более жестких условиях (t°>100°C) образуется 2,4-дисульфофенол.
г) Алкилирование по Густавcону-Фриделю-Крафтсу, а также алкенами и спиртами в присутствии катализаторов (А1Сl3, H2S04 и др.) в зависимости от условий может давать как пара-, так и орто-изомеры. Например, в присутствии серной кислоты получается пара-изомер:
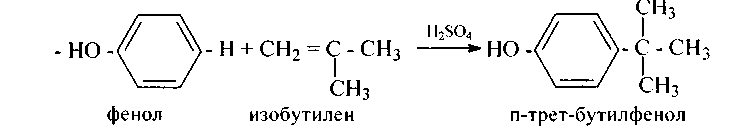
94. Приведите уравнения и механизм следующих реакций и назовите продукты:
а) м-крезол + H2S04 (20°С);
б) фенол+Н2SO4(100°С);
в) фенол+ H,S04 (t> 100°С);
г) о-крезол + этилен (А1С1 з),
д) м-крезол +пропилен (H2S04);
е) фенол+ изобутилен (H2SO4);
ж) фенол + пропилен (H2S04);
з) фенол+ H2SO4 (20°С).
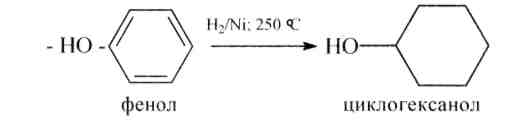
2. Гидрирование фенолов в присутствии никелевого катализатора приводит к соответствующим спиртам - циклогексанолам. Реакция имеет важное промышленное применение в производстве синтетических волокон — найлона, капрона.
95. Напишите уравнения реакции гидрирования фенолов, приведенных в упражнении 87, и назовите полученные спирты.
3. Окисление феноловидет очень легко, даже на воздухе они постепенно темнеют, загрязняются смесью орто-и пара-хинонов и других более сложных продуктов. Пероксид водорода в присутствии железного катализатора окисляет фенол в пирокатехин (выход небольшой), а хромовая смесь - в пара-бензохинон и другие более сложные продукты реакции:
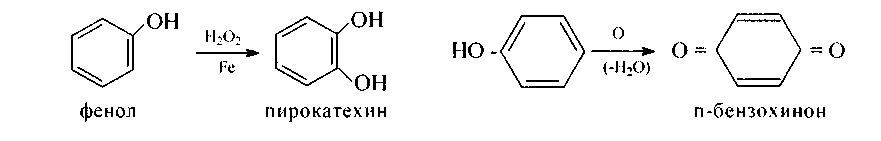
Дата добавления: 2017-05-02; просмотров: 4052;











