Химические свойства
1. Замещение галогена на гидроксил (гидролиз) осуществляется водой, водными растворами щелочей при нагревании или свежеосажденным гидрооксидом серебра:
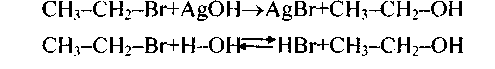
Вторая реакция обратимая. Для сдвига равновесия вправо галогеноводород удаляют щелочными агентами.
Легкость замещения падает в ряду йод-, бром- и хлорпроизводные, ибо соответственно растут энергии связей С - Гал (51, 65 и 81 ккал/моль), а также и в ряду третичный, вторичный и первичный галоген, вследствие возрастания индуктивных эффектов алкилов:
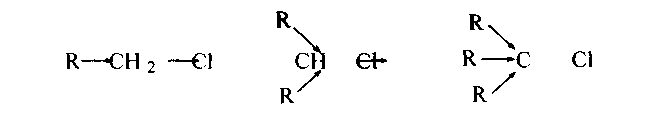
Механизм для первичных и вторичных галогеналканов - нуклеофильный, II порядка SN2:
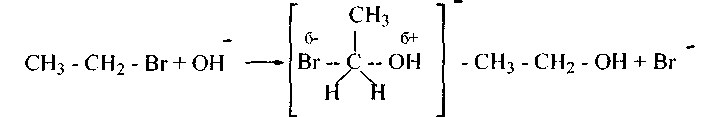
для третичных- SN1 (преимущественно), ибо атака гидроксила ОН пространственно несколько затруднена и образующийся (по механизму SN1) катион третичного алкила более устойчив:
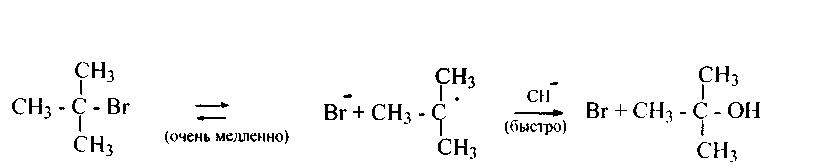
71. Приведите уравнения, условия и механизм следующих реакций: а) изобутилбромид + AgOH; б) 1-этилпропилйодид + КОН (Н20); в) аллилхлорид + Н - ОН; г) 2-хлор-З-метилбутан + КОН (Н20); д) 2-йод-2-метилпропан + Н - ОН; е) 1-бром-2-метилбутан + КОН (Н20); ж) втор-бутилхлорид + AgOH; з) изопентилйодид + AgOH; и) 2-йод-2-метилбутан + Н - ОН; к) 2-йодпентан + КОН (Н20).
2. Взаимодействие галогенопроизводных с солями неорганических и органических кислот и аммиаком (аминами)протекает при нагревании по механизму нуклеофильного замещения SN2, через активированный комплекс:
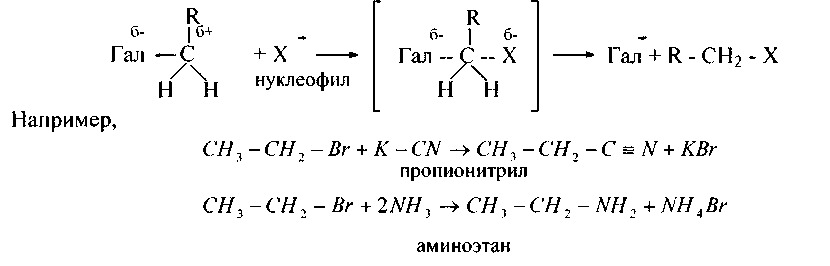
Аналогичны реакции с AgN02, NaI, NaSH, NaOR, NaOCOR и др., с помощью которых получают нитросоединения (R-N02), йодалканы (R-I), тиолы (R-SH), простые и сложные эфиры (R-O-R), (R-O-CO-R) и т.д.
72. Напишите уравнения реакций получения нитрилов, аминов, нитросоединений, йодалканов, тиолов из следующих галогенопроизводных. Приведите механизм одной из пяти реакций.
а) пропилбромид; б) 2-бром-2-метилпропан; в) втор-бутилбромид; г) изопропилхлорид; д) изобутилбромид; е) 1-бром-2-метилбутан; ж) 2-хлорпентан; з) 1-хлор-З-метилбутан; и) 2-хлор-З-метилбутан; к) 3-хлорпентан.
3. Взаимодействие галогенопроизводных с металламишироко применяется в органическом синтезе. Большое значение имеет реакция Гриньяра. Она не зависит от природы галогена (за исключением фтора - фтористые алкилы не реагируют с магнием и даже с литием) и органического радикала идет в среде абсолютного диэтилового эфира при слабом его кипении:
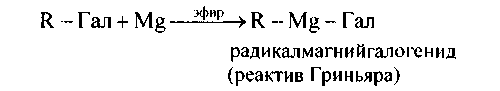
По-видимому, передача электрона с кристаллической решетки металла (или с поверхности капли жидкого натрия в реакции Вюрца) на углерод, связанный с галогеном, приводит к образованию свободного радикала и заряженных частиц, которые рекомбинируются по-разному:
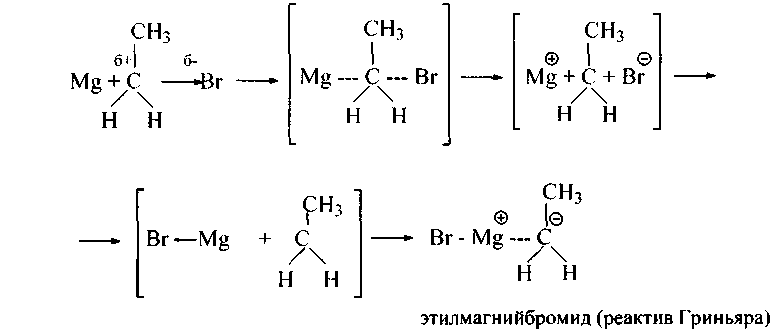
В данном случае образуется ионная связь магний-углерод (реактив Гриньяра), в других случаях образуются углерод-углеродные σ- и π-связи в реакциях Вюрца, Вюрца-Фиттига и др.
Радикалмагнийгалогениды очень активны, устойчивы только в абсолютном эфире, небольшое присутствие соединений с подвижным водородом приводит к взаимодействию:
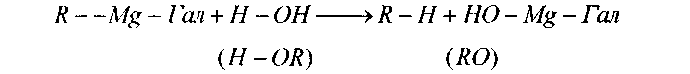
4. К действию окислителей галогенопроизводные довольно устойчивы. Восстановители превращают их в углеводороды:
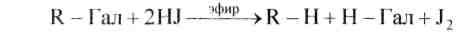
73. Напишите уравнения следующих реакций, назовите полученные соединения: 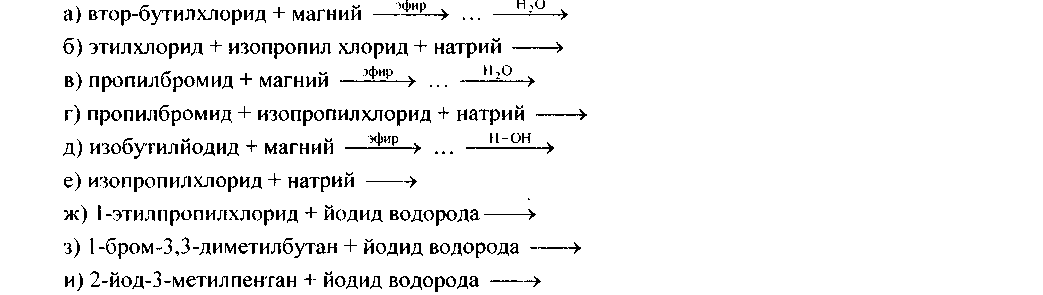
Из других свойств галогенпроизводных следует отметить уже знакомые изученные реакции, приводящие к получению углеводородов. Это реакция дегидрогалогенирования моно- и дигалогеналканов спиртовой щелочью, дегалогенирования дигалогеналканов цинковой пылью в спирте, амальгамой лития в диоксане, реакции Вюрца, Вюрца - Фиттига, Густавсона-Фриделя-Крафтса.
IX. СПИРТЫ
R(OH)n - общая формула. Число n, показывающее количество гидроксильных групп (ОН) групп, или оксигрупп), определяет и атомность спиртов. Одноатомные, двухатомные и другие многоатомные спирты в зависимости от строения радикала могут относиться к предельным, непредельным, циклическим и ароматическим спиртам.
Дата добавления: 2017-05-02; просмотров: 4630;











