Химические свойства бензола и его гомологов
Бензольное ядро довольно устойчиво. Оно более склонно к реакциям замещения атомов водорода бензольного кольца, нежели к реакциям присоединения по месту разрыва двойных связей. В этом выражении его «ароматический характер».
Реакции замещения
Наиболее характерны реакции электрофильного замещения: нитрирование, сульфирование, алкилирование (ацилирование), галогенирование (галогенирование гомологов бензола может идти и по радикальному механизму.
1. Нитрование - замещение водорода бензольного кольца нитрогруппой - проводят так называемой нитрирующей смесью - смесью концентрированных азотной и серной кислот. Действующим агентом является катион нитрония N02+:
НО - N02 + 2H2S04 →N02+ + 2HS04- + H30
Нитроний катион гидроксоний катион
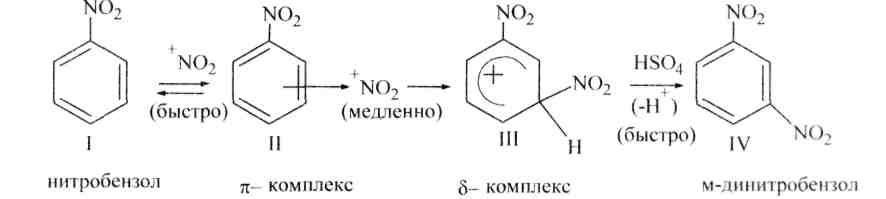
Механизм нитрования (как и всех реакций замещения) следующий:
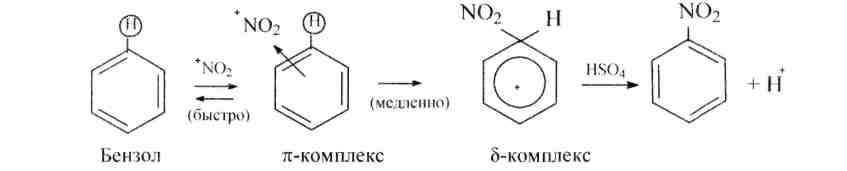
Присутствие воды в реакционной смеси мешает течению реакции, т.к. вода участвует в процессе, обратном образованию катиона нитрония. Поэтому для связывания выделяющейся в реакции воды берут избыток концентрированной серной кислоты.
Правила замещения водородов бензольного ядра. Если в бензольном ядре имеется какой-нибудь заместитель водорода, то в реакциях электрофильного замещения он играет роль ориентанта - реакция идет преимущественно в орто- и пара-положения по отношению к заместителю (ориентант I рода) или в мета-положения (ориентант II рода).
Заместители I рода направляют атакующий электрофил в орто- и пара-положения по отношению к себе. Приводим их в порядке убывания ориентирующей силы (электродонорного эффекта):
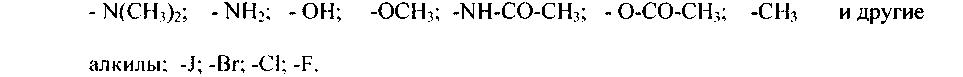
Заместители II рода направляют атакующий электрофил в мета-положения по отношению к себе. Приводим их также в порядке убывания ориентирующей силы:
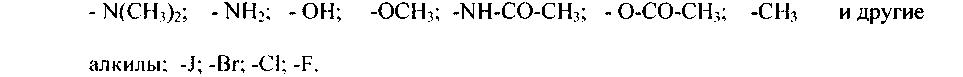
Например, -ОН - группа - ориентант I рода:
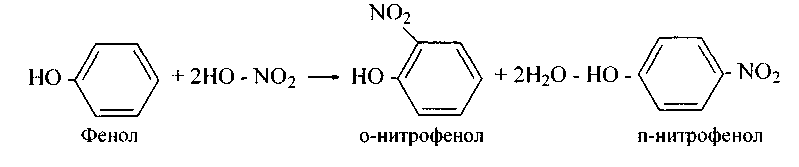
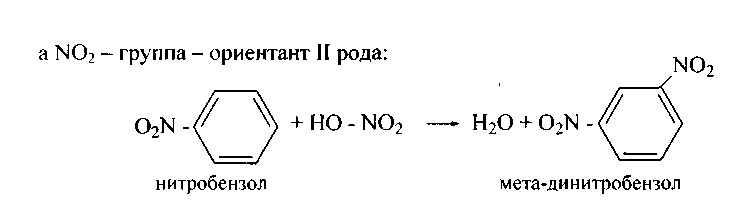
59. Напишите уравнение и механизм реакций нитрования следующих соединений: а) бензол; б) толуол; в) хлорбензол; г) нитробензол; д) сульфобензол; е) цианистый фенил; ж) метоксибензол; з) аминобензол.
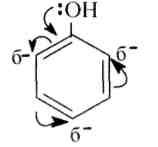
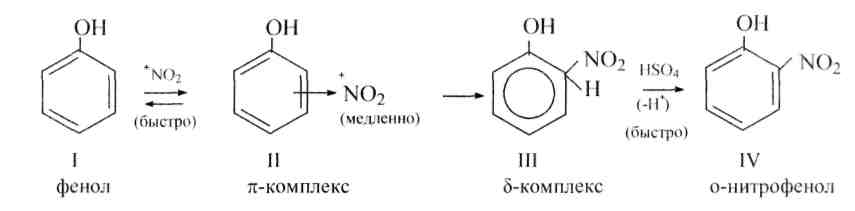
Заместители I рода являются электродонорными, они увеличивают плотность электронного облака бензольного ядра, особенно в орто- и пара-положениях и тем самым (облегчают) активируют бензольное ядро к атаке электрофила. Однако σ-комплекс (III) стабилизируется не присоединением аниона, а отщеплением катиона водорода (энергия, выделяющаяся при образовании единого π-электронного облака бензольного ядра, 36,6 ккал/моль):
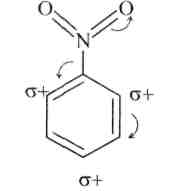
Заместители II рода являются электроноакцепторными, они как бы оттягивают на себя часть электронного облака, тем самым уменьшают плотность электронного облака бензольного ядра, особенно в орто- и пара-положениях по отношению к себе. Заместители II рода в общем-то затрудняют реакции электрофильного замещения. Но в мета-положениях по отношению к заместителю II рода плотность облака несколько выше, чем в других. Поэтому реакции электрофильного замещения в случае заместителей II рода идут в мета-положения:
|
Описанные выше правила не носят характера законов. Речь почти всегда идет только о главном направлении реакции. Например, при нитровании толуола образуется 62 % орто-, 33,5 % пара- и 4,5 % мета-нитротолуолов.
Довольно сильное влияние на направления реакций оказывают условия проведения (температура, присутствие катализаторов и др.).
При наличии двух ориентантов в бензольном ядре возможна согласованная и несогласованная ориентация этих двух заместителей. В случае несогласованной ориентации заместителей одного рода направление реакции определяет более сильный (см. ряды заместителей I и II рода):
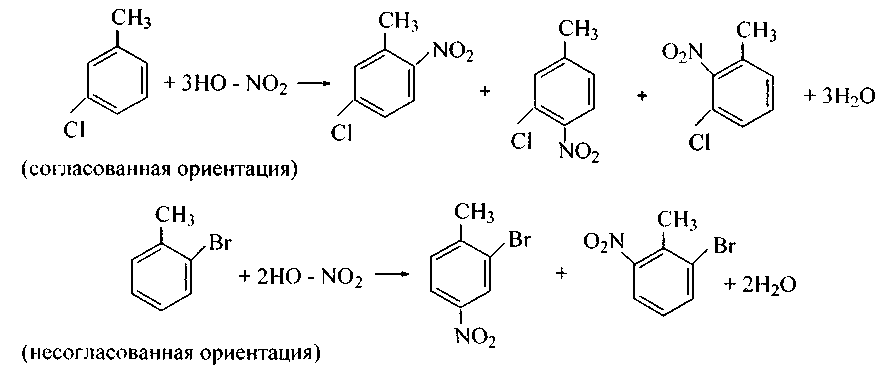
В случае несогласованной ориентации заместителей разного типа направление реакции определяет заместитель I рода, так как он активирует бензольное ядро к электрофильной атаке, например,
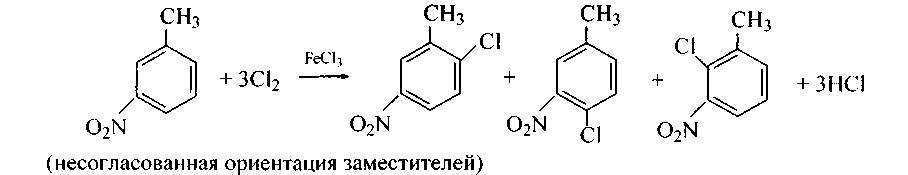
60. Согласно правилам замещения, напишите нитрование следующих двузамещенных бензола: а) м-нитротолуола; б) п-нитротолуола; в) о-окситолуола; г) п-хлортолуола; д) м-нитробензойной кислоты; е) п-оксихлорбензола; ж) м-хлортолуола; з) п-метокситолуола.
2. Реакция сульфирования протекает при нагревании аренов с концентрированной серной кислотой или олеумом. Атакующим агентом является молекула SO3, играющая роль электрофила:
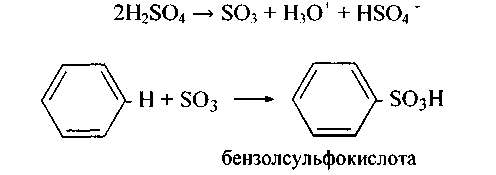
Первая стадия сульфирования - медленная, реакция в целом обратимая:
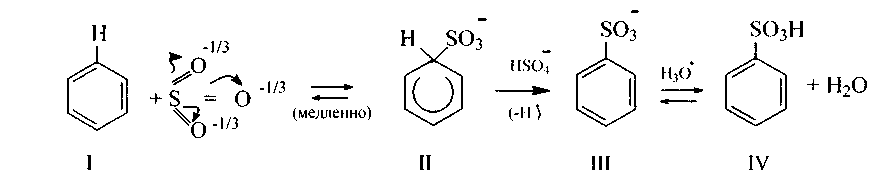
Сульфокислоты по силе сравнимы с минеральными, поэтому в водных растворах они находятся в ионизированном состоянии (III).
61. Приведите уравнения и механизмы реакций сульфирования следующих веществ, придерживаясь правил замещения:
а) толуола; б) о-ксилола; в) нитробензола; г) о-нитротолуола; д) п-хлорнитробензола; е) м-нитротолуола; ж) п-аминотолуола; з) о метокситолуола.
3. Реакция галогенирования аренов на холод в присутствии катализаторов типа AlCl3, AlBr3, FeCl3 - типичная электрофильная реакция, ибо катализаторы способствуют поляризации связи в молекуле галогена (вплоть до ее разрыва): 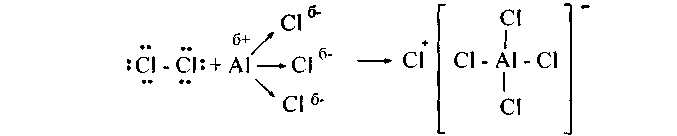
Таким же образом действует и безводное хлорное железо:
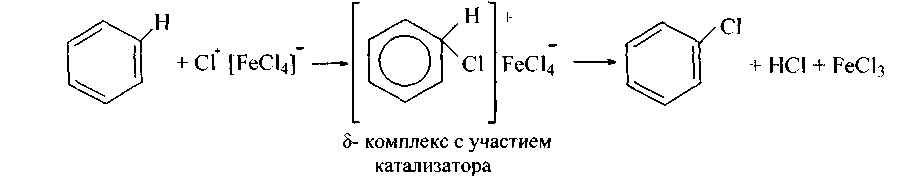
В условиях радикальной реакции (свет, нагревание) галогены (хлор, бром) замещают водороды боковых цепей (аналогично галогенированию алканов):
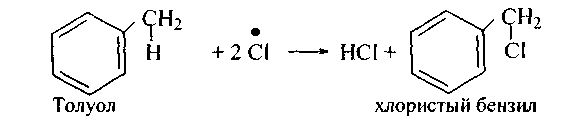
В более жестких условиях происходит и радикальное присоединение галогенов к ароматическому ядру.
62. Напишите уравнения и механизмы реакции и назовите продукты:
а) толуол + хлор (при ярком свете и нагревании);
б) толуол + хлор (на холоду в присутствии катализатора);
в) нитробензол + хлор (на холоду в присутствии катализатора);
г) п-нитротолуол + хлор (при ярком свете и нагревании);
д) п-нитротолуол + хлор (на холоду в присутствии катализатора):
е) этилбензол + хлор (при ярком свете и нагревании);
ж) этилбензол + хлор (на холоду в присутствии катализатора);
з) п-окситолуол + хлор (на холоду в присутствии катализатора);
и) м-нитротолуол + хлор (на холоду в присутствии катализатора);
к) м-ксилол + хлор (на холоду в присутствии катализатора).
4. Алкилирование аренов. В присутствии безводного AlCl3 (А1Вrз) галогеналканы алкилируют бензол, еще легче, чем его гомологи, а также их галогенпроизводные (реакции Густавсона-Фриделя-Крафтса). Катализатор, образуя комплекс А1Сl3, поляризует связь С-Гал вплоть до разрыва ее, и поэтому атакующий агент-электрофил:
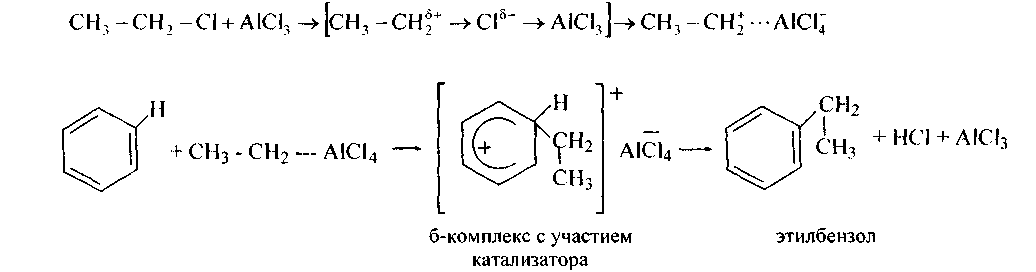
Алкилирование алкенами в присутствии А1Сl3, BF3 или Н3РО4 приводит к аналогичным результатам (механизм тоже электрофильный):
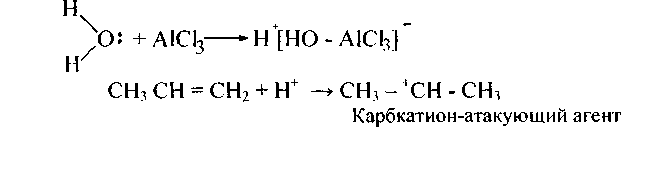
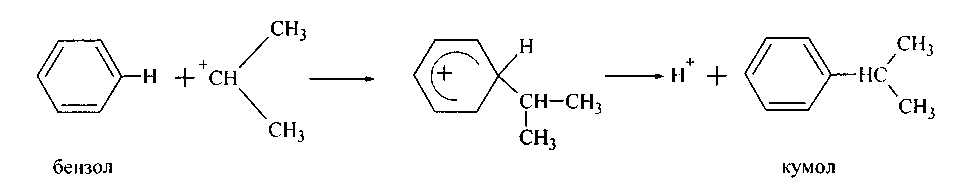
Алкилирование галогеналканами и алкенами как электрофильные реакции идут в соответствии с правилами замещения водородов бензольного кольца. Однако процесс осложняется дальнейшим алкилированием продуктов реакции и другими нежелательными явлениями. Чтобы последние свести к минимуму, реакцию ведут при возможно низкой температуре, оптимальном количестве катализатора и большом избытке арена.
63. Приведите уравнения и механизм реакций в условиях Густавсона-Фриделя-Крафтса между следующими веществами:
а) бензол + 2-хлорпропан; б) бензол + 2-хлор-2-мегилпропан; в) бензол + бензилхлорид; г) бромбензол + бромэтан; д) толуол + бутилхлорид; е) толуол + бромэтан; и) п-бромтолуол + изопропилбромид; з) м-бромтолуол + бромэтан; и) п-бромтолуол + изопропилбромид; к) хлорбензол + бензилхлорид.
64. Напишите уравнения реакций алкилирования аренов алкенами в присутствии фосфорной кислоты, приведите механизм:
а) бензол + этилен; б) бензол + пропилен; в) толуол + этилен; г) толуол + пропилен; д) бензол + изобутилен; е) толуол + изобутилен; ж) м-ксилол + этилен; з) п-ксилол + этилен.
5. Реакция окисления (определение числа боковых цепей). Ароматическое ядро очень устойчиво к окислителям. Так, бензол и его гомологи не реагируют с перманганатом калия подобно алканам. В этом тоже выражается их «ароматический характер». Но при нагревании гомологов бензола с окислителями в жестких условиях бензольное ядро не окисляется, а все боковые углеводородные цепи, независимо от их длины, окисляются до карбоксильных групп, продуктами окисления являются ароматические кислоты. По количеству карбоксильных групп в последних судят о числе боковых цепей в исходном гомологе бензола1.
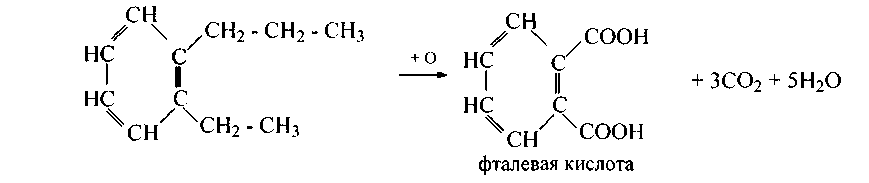
65. Напишите уравнения реакций окисления следующих веществ: а) этилбензол; б) о-диметилбензол; в) пропилбензол; г) рядовой триметилбензол; д) п-метилизопропилбензол; е) о-нитротолуол; ж) 3-нитро-1-метил-4-этилбензол; з) симметричный триметилбензол.
6. Реакции присоединения. Хотя ароматическое ядро менее склонно к реакциям присоединения, чем замещения, в некоторых условиях они имеют место. Особенностью реакций присоединения является то, что к одному молю бензола (или его гомолога) всегда присоединяется по три моля галогена, водорода, озона, что объясняется наличием у ароматического ядра единого π-электронного облака с определенной единой, общей энергией трех двойных связей (вернее, шести π-электронов).
а) Гидрирование идет в присутствии катализаторов (Pt, Pd и др.) при 110°С (Н.Д. Зелинский и др.).
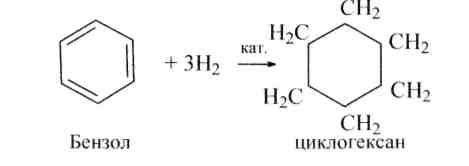
б) Галогенирование идет при пропускании паров брома или хлора через кипящий бензол под действием прямого солнечного света или при освещении УФ-лучами (кварцевая лампа):
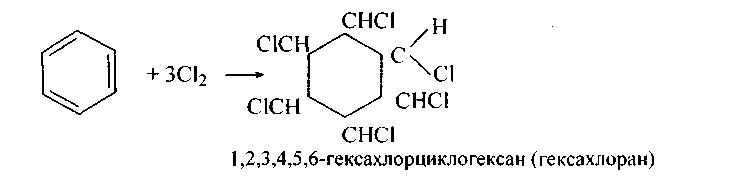
в) Озонирование. Подобно алкенам ароматические углеводороды легко подвергаются озонолизу.

66. Напишите уравнения реакций присоединения (гидрирования, галогенирования при освещении УФ-лучами, озонирования) со следующими аренами: а) толуол; б) о-ксилол; в) м-ксилол; г) п-ксилол; д) этилбензол; е) о-этилтолуол; ж) м-этилтолуол; з) п-изопропилтолуол. Назовите полученные продукты.
ЧАСТЬ II
Дата добавления: 2017-05-02; просмотров: 11758;











