Простых непредельных углеводородов
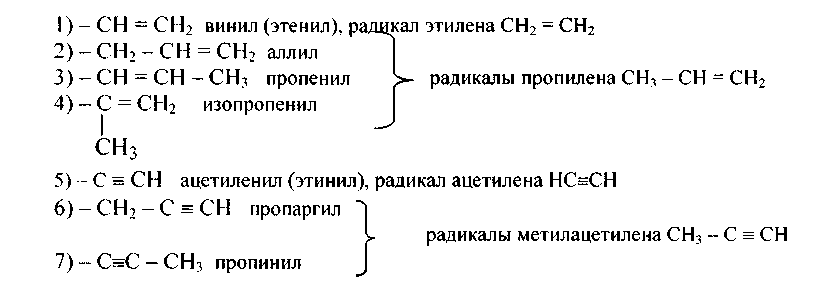
9. Приведите формулы следующих углеводородов и назовите (где это возможно) по рациональным (метановой, этиленовой, ацетиленовой, алленовой) номенклатурам, используя названия одновалентных радикалов предельных и непредельных углеводородов: а) бутадиен-1,2; б) пентадиен-1,4; в) бутадиен-1,3; г) 2,4-диметилпентадиен-2,3; д) гексадиен-1,5; е) бутен-З-ин-1; ж) 2,4-диметилпентадиен-1,4; з) 2-метилбутадиен-2.3; и) гексен-5-ин-1; к) 3.3-диметилпентадиен-1,4.
Индивидуальные задания по второй теме
Общие задания по второй теме
1. Приведите формулы всех изомеров пентена (С5Н10) и назовите их по рациональной и систематической номенклатурам. Укажите, какие из них имеют геометрические изомеры. В двух примерах укажите равноценные углеродные атомы.
2. Приведите формулы всех изомеров общей формулы С5Н8 и назовите их по всем известным номенклатурам.
III. СПОСОБЫ ПОЛУЧЕНИЯ И ХИМИЧЕСКИЕ СВОЙСТВА ПРЕДЕЛЬНЫХ УГЛЕВОДОРОДОВ
Получение алканов
1. Аналитическийспособ. Алканы получают при нагревании смеси соли какой-либо карбоновой кислоты с твердой щелочью (чаще с натронной известью), например,
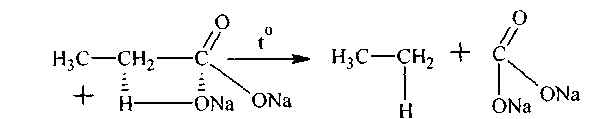
смесь для получения этана, этан сода, углекислый натрий
прокаленного пропионата Nа
и натронной извести
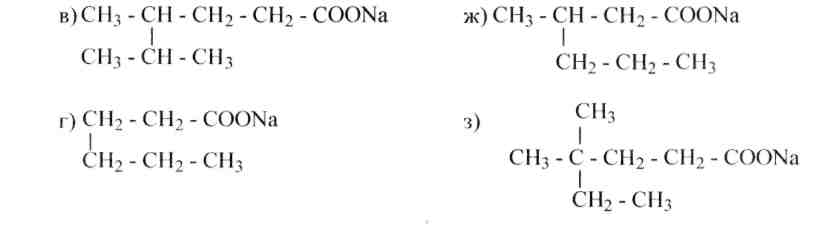
10. Назовите алканы, получающиеся при нагревании с натронной известью следующих солей карбоновых кислот:
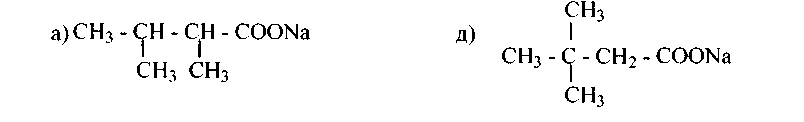

2. Восстановление галогеналкановводородом в момент выделения (амальгамой натрия, цинком в соляной кислоте), особенно йодоводородом при высокой температуре, приводит к алканам: СН3 - СН2 - I 2[H] HI + СН3 -СН3
СН3 - СН2 - Сl + 2HI → НС1 + I2 + СН3 - СН3
11. Напишите уравнение следующих реакций и назовите углеводороды:
а) 1-йод-2,4-диметилпентан + НI →
б) 2-бром-3,4-диметилгексан + НI →
в) 1-хлор-2,3-диметилбутан + Zn + HCI →
г)1-йод-3-метилбутан + Нgn(Na) + H- OH→
д) 2-хлорпентан + НI →
е) 1-бром-2-метилпропан + Zn + НСl→
ж) 2-йод-4,4-диметилпентан + Нgn(Na) + Н - ОН →
з) 1-хлор-3,4-диметилпентан + HI →
3. Реакция Вюрца.Ученик Либиха Вюрц получил алканы при действии металлического натрия на галогеналканы. Первичные галогеналканы дают хорошие выходы. Третичные даже в присутствии катализаторов (соединения ртути и одновалентной меди) дают низкие выходы, около 20%. Реакция идет в две стадии (Шорыгин):
I стадия СН3 −СН2 −Вr + 2Na →NaВr + СН3 −СН2 − Na
II стадия СН3 −СН2 − Na + Вr-−СН2 - СН3 → NaВr + СН3 −СН2 −СН2 – СН3
Механизм передачи электронов на углерод 1-ой стадии аналогичен приведенному в реакции Гриньяра.
В случае использования двух разных галогеналканов в качестве исходных веществ в этой реакции получается смесь трех углеводородов, например,
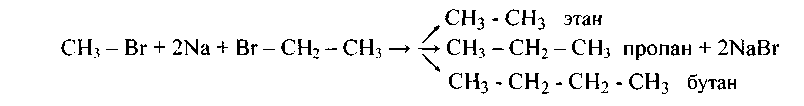
Скорость движения частиц при одной и той же температуре обратно пропорциональна их массе. Выходы продуктов реакции при других равных условиях находятся, видимо, в той же зависимости.
Из такой смеси нужный продукт не всегда легко бывает выделить.
12. Напишите уравнения реакций Вюрца и назовите продукты реакции по известным номенклатурам:
а) бутилхлорид + этилбромид (3 углеводорода);
б) втор-бутилхлорид + бромэтан (3 углеводорода);
в) изобутилхлорид + 2-хлорпропан (3 углеводорода);
г) изопропилйодид + 2-йод-2-метилпропан (3 углеводорода);
д) трет-бутилбромид + этилхлорид (3 углеводорода);
е) 2-хлор-2-метилпропан + 2-бромпропан (3 углеводорода);
ж) 2-хлорпропан + 2-хлор-З-метилбутан (3 углеводорода);
з) 2-хлорпропан + 1-хлор-З-метилбутан (3 углеводорода).
13.Из соответствующих галогеналканов получите по реакции Вюрца: а) 2-метилбутан; б) изобутан; в) 2,3-диметилбутан; г) бутан; д) 2,2-диметилбутан; е) н-пентан; ж) 2-метилпентан; з) 3-метилпентан.
14.Имея изопропилбромид в качестве одного из исходных веществ, получите по реакции Вюрца:
15.а) изобутан; б) 2,3-диметилбутан; в) 2-метилбутан; г) 2-метилпентан; д) 2-метилгексан; е) 2,3-диметилпентан; ж) 2,4-диметилпентан; з) 2,2,3-триметилбутан.
В этой теме в упр. 10-14 приведены химические реакции. Однако, чтобы далее во всех темах пособия эти реакции были рассмотрены не формально, а чуть несколько глубже - с объяснениями механизмов и их энергетики, мы ниже перед тем как перейти к химическим свойствам алканов приводим в наиболее простой и доступной форме, как нам кажется, понятия о строении атомов (петит), о типах связей между ними (они-то и рвутся, и создаются вновь в химических реакциях), о валентных состояниях углерода (составляющего скелеты органических молекул), о механизмах энергетических кривых реакций, включая туннельные эффекты каталитических и ферментативных процессов.
Дата добавления: 2017-05-02; просмотров: 4737;











