Химические свойства алканов
1. Реакции галогенирования.Фтор с алканами реагирует со взрывом, йод - не реагирует. Йодпроизводные получают реакциями обмена, присоединением йодистого водорода к непредельным углеводородам и из спиртов.
Бромирование алканов, инициируемое светом, идет преимущественно по третичному атому. Более распространено хлорирование, дающее смесь монохлоралканов - хлор активнее. Однако селективность хлорирования алканов возрастает в среде бензола (его гомологов) из-за образования непрочных комплексов их с хлором, и активность хлора приближается к активности брома:
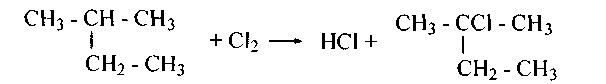
15. Напишите уравнения монохлорирования следующих алканов и назовите продукты:
а) пропан + Сl2 (2 вещества); б) бутан + Сl2 (2 вещества); в) изобутан + Сl2 (2 вещества); г) пентан + Cl2 (3 вещества); д) изопентан + С12 (4 вещества); е) гексан + Сl2 (3 вещества); ж) 2-метилпентан + С12 (5 веществ); з) 3-метилпентан + С12 (4 вещества); и) 2,3-диметилбутан + С12 (2 вещества); к) 2,2-диметилбутан + С12(3 вещества).
Механизм реакции радикальный. Радикалы - инициаторы реакции порождаются действием света или нагревания:
hν
а) С1-С1 → 2CI· реакция - донор радикалов.
Радикалы вызывают бесконечно повторяющуюся цепь реакций:
Cl·+ Н-СН3 → НС1 + СН3·
СН3·+ С1 -С1 → СН3·−С1 + С1· и т.д.
Однако существуют процессы, поглощающие радикалы и обрывающие цепи реакций:
б) 2С1·→ С1 - С1; С1· + СН3· → СН3С1
2 СН3·→ СН3-СН3
б) реакции акцепторы радикалов.
Соотношение скоростей реакций а) и б) обусловливает скорость галогенирования алканов.
Избирательность замещения при галогенировании алканов зависит от условий. Так, отношение скоростей отрыва водородов от СН3, СН2, СН -групп (оно не зависит от структуры алкана) при нагревании в газовой фазе (100°С) составляет (1:4,3:7), при освещении - (1:3,8:5), а при 300°С - (1:3,3:4,4), т. е. избирательность уменьшается при увеличении энергии и концентрации радикалов.
Зная число атомов Н при разных углеродах, можно рассчитать выходы монохлоралканов. Например, галогенирование изопентана дает смесь (при 300°С):
|

|

|
Цифра 20 в знаменателе получается от суммирования числителей дробей 1- 4 (6+ 3 + 6,6 + 4,4 = 20), в противном случае общий выход (сумма выходов) не будет равен 100%.
Эти данные неплохо согласуются с экспериментом и тем фактом, что энергии диссоциации связей С—Н понижаются на 2 – 5 ккал/моль при переходе от первичного к вторичному, от вторичного к третичному углероду.
16. При монохлорировании следующих алканов рассчитайте выходы разных монохлорпроизводных, используя вышеприведенные отношения в трех разных условиях (при 100°С, при освещении и при 300°С): а) пропана; б) изобутана; в) бутана; г) изопентана; д) 2,3-диметилбутана; е) 3-метилпентана; ж) неогексана; з) изооктана (2,2,4-триметилпентана).
2. Нитрование.При обычной температуре алканы устойчивы к нитрующим агентам (НNО3 конц., N02). Однако уже в условиях реакции Коновалова (с 10% НNО3 в ампуле, 140°С) водород вторичного и, особенно, третичного углерода замещается на нитрогруппу (N02) гораздо легче первичного. Эта избирательность, объясняемая различием энергии диссоциации С—Н связей и различием устойчивости промежуточно образующихся радикалов,наблюдается и при нитровании алканов с оксидами азота при повышенной температуре:
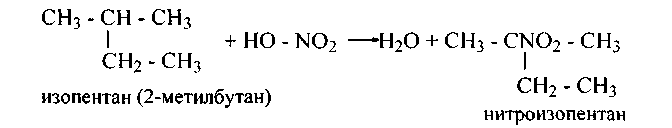 2-нитро-2-метилбутан
2-нитро-2-метилбутан
17. Напишите уравнения реакций мононитрования в условиях Коновалова следующих углеводородов, назовите продукты, объясните механизм и направление реакций.
а) пентан; б) изобутан; в) 2-метилпентан; г) 2,3-диметилбутан; д) 2,4-диметилпентан; е) 2,2,4-триметилпентан; ж) 3-метилпентан; з) 2,3-диметилпентан.
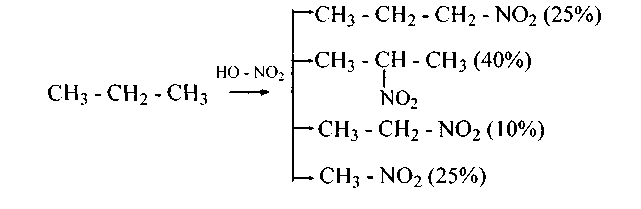
При температурах выше 400°С (промышленные условия) вышеприведенной избирательности почти нет. Механизм радикальный, процесс сопровождается деструкцией алкана. Например:
3. Сульфированиеалканов осуществляют дымящей серной кислотой (олеумом), при этом замещается третичный водород на сульфогруппу (SO3H) - образуются алкилсульфокислоты:
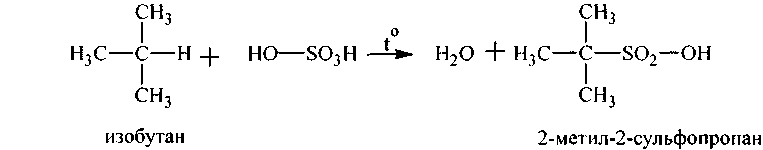
Процесс идет довольно медленно даже при нагревании. Поэтому в промышленности используют смесь сернистого газа (S02) и хлора (С12) вместо олеума.
Сульфохлорирование- процесс радикальный - инициируется фотохимически ультрафиолетовым светом:
С12 h ν 2Cl·; R-H+CI·→HC1+R·;
R·+S02→R-S02·; R-S02·+C12→R-S02-C1+C1·и т.д.
18.Напишите уравнения реакций сульфирования дымящей серной кислотой и сульфохлорирования смесью сернистого газа и хлора следующих алканов:
а) диметилэтилметан; б) метилдиэтилметан; в) триметилметан; г) диметилпропилметан; д) диметилизопропилметан; е) диизопропилметан; ж) триметилизопропилметан; з) изопропил-трет-бутилметан.
4. Реакция термического распада (крекинг).Под действием высокой температуры у алканов происходит разрыв углерод-углеродной связи (σ-связи) с образованием алканов и алкенов с меньшим числом углеродных атомов, например:
Н3С−СН2−СН3 t° СН4 + СН2 =СН2
19. Какие алканы и алкены могут образоваться при термическом крекинге следующих углеводородов;
а) бутан; б) изобутан; в) н-пентан; г) 2-метилбутан; д) 2,3-диметилбутан; е) неопентан; ж) неогексан; з) 3-метилпентан.
5. Реакция дегидрирования.Эта реакция протекает под действием специальных катализаторов (например, Pt) при высокой температуре и давлении. Например, СН3−СН2− СН3 кат., р, t  H2 +CH3 −CH=CH2
H2 +CH3 −CH=CH2
20. Какие алкены могут образоваться при каталитическом дегидрировании следующих углеводородов? Приведите уравнения соответствующих реакций:
а) бутан; б) изобутан; в) н-пентан; г) 2-метилбутан; д) 2,3-диметилбутан; е) неопентан; ж) неогексан; з) 3-метилпентан.
Дата добавления: 2017-05-02; просмотров: 6881;











