Понятия о механизме органических реакций
Химические реакции имеют место в тех случаях, когда в молекулах разрываются связи между какими-нибудь атомами и появляются новые связи.
Большинство связей в органических молекулах являются ковалентными. Ковалентная связь между атомами А и Б образована одной общей для обоих атомов парой электронов:
А:Б
Такая связь может разрываться двояко:
а) пара электронов делится (распадается), и частицы А и Б получают по одному электрону и становятся свободными радикалами:
А : Б →А·+ Б· (А· иБ· — свободные радикалы) (гомолитическое расщепление связи)
б) пара электронов полностью остается у одного атома, а другой лишается электрона (заряжается положительно):
А : В → А++ : Б- (А+ и: Б- - ионы)
(гетеролитическое расщепление связи)
Получившиеся заряженные частицы (ионы) подчиняются законам электростатического притяжения и отталкивания.
В отличие от ионов, свободные радикалы зарядов не имеют и их реакции не подчиняются законам, характерным для ионных превращений.
Каков механизм реакции - свободнорадикалъный или ионный - можно установить, изучив экспериментальные условия, благоприятствующие течению реакции.
Свободнорадикальные реакции: 1) катализируются светом, высокой температурой или присутствием веществ, легко дающих другие свободные радикалы; 2) тормозятся веществами, легко реагирующими со свободными радикалами, например, такими, как гидрохинон или дифениламин; 3) проходят в неполярных растворителях или в паровой фазе и т. д.
Ионные реакции: 1) катализируются кислотами и основаниями и не подвержены влиянию света или свободных радикалов (в частности, возникающих при разложении перекисей): 2) не подвержены влиянию акцепторов свободных радикалов: 3) редко происходят в паровой фазе; на ход реакции оказывает влияние природа растворителя.
Для ионных реакций имеет значение природа атакующего реагента. Реагенты, отдающие свою электронную пару для образования новой связи, называются нуклеофилъными (или электронодонорными) и, наоборот, реагенты, приобретающие для образования новой связи электронную пару (которая ранее полностью принадлежала другой молекуле), называются электрофильными (электроноакцепторными).
Расщепление σ-связи С—С между углеродными атомами (длина связи 1,54 А°) требует меньшей энергии (83 ккал/моль), чем связи С—Н между углеродом и водородом (длина связи 1,1 А°, энергия связи 98,8 ккал/моль). Однако у насыщенных органических соединений химические реакции идут чаще с расщеплением связи С—Н, так как эти связи более доступны действию реагентов. Это в основном реакции замещения и окисления.
Реакции замещения могут протекать по ионному или радикальному механизму. Эти реакции условно обозначаются буквой S (замещение по латыни - substitutio). Реакции нуклеофильного замещения условно обозначаются SN, электрофильного замещения - SE, радикальные — SR. Эти реакции схематически можно представить так:
А:Б + :С-→А:- +Б:С(SN);
А : Б + С+ → А+ + Б : С (SE);
А:Б + С→А·+Б:С (SR).
Существует понятие «порядок реакции». В основном реакции бывают I и II порядка, реакции III порядка очень редки. Скорость реакции может зависеть от концентрации и особенностей только одного из исходных веществ (реакции I порядка) или двух исходных веществ (реакции II порядка). В зависимости от этого механизмы реакций обозначаются, Например, SN 2, SE 1 и т.д.
У алканов реакции замещения идут преимущественно по радикальному механизму. Причем, водород при третичном атоме углерода имеет наиболее слабую (разрыхленную) связь. Энергия гомолитического разрыва С—Н связи у третичного атома ниже на 5 - 7 ккал/моль, чем у СН2− и СНз− групп соответственно из-за индуктивных эффектов алкилов:
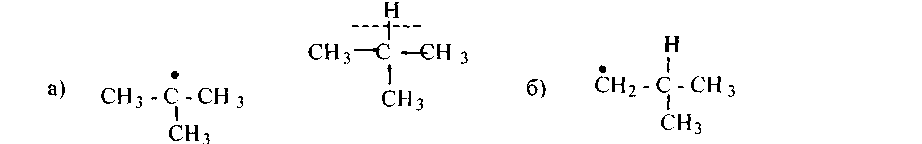
|
И, кроме того, образующиеся свободные радикалы, имеющие свободный электрон при третичном атоме углерода, наиболее устойчивы. Радикал (а) более устойчив (и потому более вероятно его образование), чем радикал (б), ибо свободный электрон лучше делокализуется, если он взаимодействует с большим числом электронных пар С—Н связей соседних углеродов. По этим причинам реакции замещения у алканов преимущественно идут по третичному атому углерода.
Ненасыщенные органические соединения имеют в молекуле качественно отличные от обычных (одинарных) - π-связи (двойные, тройные) между углеродными атомами. Электроны π -связей находятся в весьма активном состоянии, в котором они легко поддаются действию электрических и электромагнитных полей (легкая поляризуемость). Это обусловливает большую химическую активность ненасыщенных соединений. Для таких соединений наиболее характерны реакции присоединения и полимеризации, идущие и по ионному, и по радикальному механизму. Например, правило В.В. Марковникова соблюдается только при ионном (электрофильном) механизме присоединения галогеноводородов:
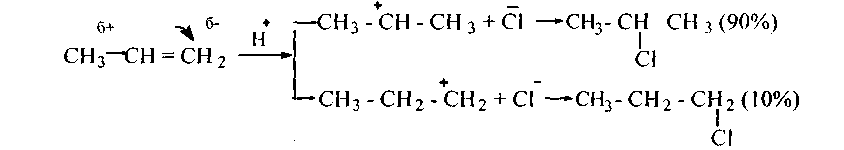
Кроме того, верхний катион более устойчив (и потому более вероятно его образование), чем нижний катион, ибо положительный заряд (свободная орбита) верхнего катиона может взаимодействовать с парами электронов шести С—Н связей соседних углеродов, в то время как в нижнем катионе - только с двумя С—Н связями соседнего углерода.
|
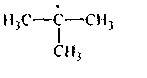
|
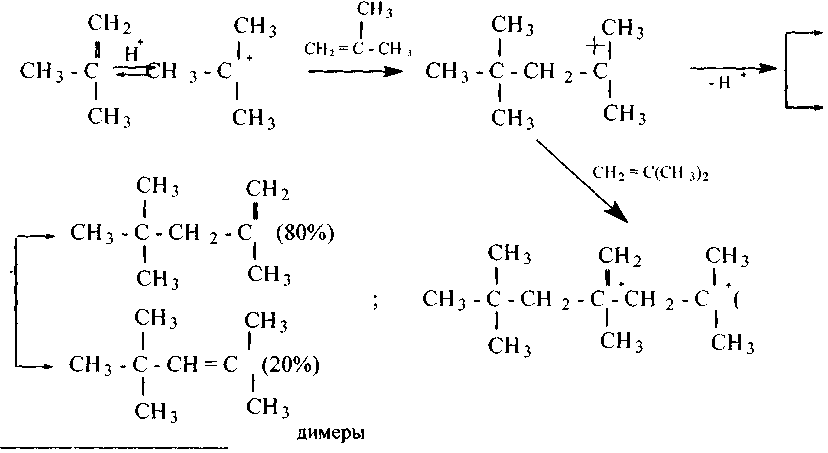
Ступенчатая полимеризация алкенов, впервые осуществленная А. М. Бутлеровым, протекает по ионному электрофильному механизму и дает, олигомеры (в основном димеры, тримеры):
Радикальная полимеризация вызывается веществами, способными в условиях реакции распадаться на свободные радикалы (перекиси, диазоаминосоединения и др.). Растущая цепь полимера вплоть до стабилизации представляет собой свободный радикал:
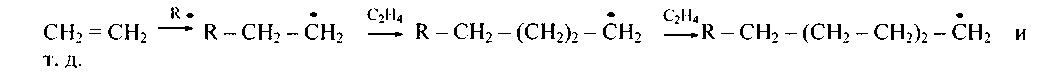
Процесс идет по цепному механизму и заканчивается получением высокомолекулярного полимера.
Очень многие реакции происходят непосредственно между молекулами органических соединений. При таких реакциях разрыв прежних, образование новых связей в реагирующих молекулах происходит синхронно в реакционноактивированном комплексе, в котором все изменяющиеся связи ослаблены (молекулярный механизм):
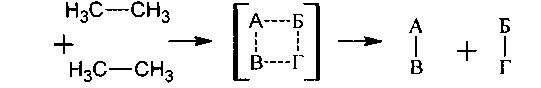
Такие реакции относятся к реакциям II порядка, в них скорость реакции зависит от концентраций обоих реагентов.
Следует отметить, что такой реакционный комплекс имеет переходный характер и не может быть изолирован. Это удобно иллюстрируется на энергетической кривой реакции.(рис 1.)
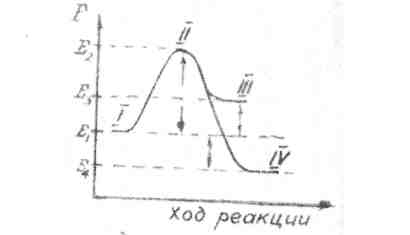
Рис. 1.
Е1 - энергия начального состояния (1), Е2 - энергия активированного комплекса, или переходного состояния (II), ∆ Е = (Е2 – Е1) -энергия активации, или энергетический барьер реакции, ∆Е = (Е3 – Е1]) - энергия, поглощенная системой в эндотермической реакции (в переходе из I состояния в III, ∆Е2 = (Е1 - Е4) - энергия, выделенная в экзотермической реакции (в переходе из I состояния в IV).
Чем выше энергетический барьер реакции, тем более устойчиво вещество (не склонно к реакции). Такими качествами должны отличаться полимеры, используемые в технике, в быту.
Чтобы переходное состояние имело хоты бы самую малую устойчивость (т.е. чтобы оно стало промежуточным соединением), оно должно на вершине кривой иметь «ямку» (с краями-барьерчиками, рис. 2).
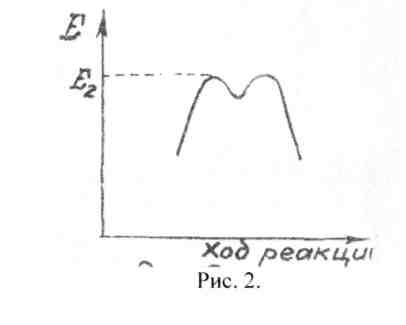
Следовательно, если активированный комплекс (переходное состояние) невозможно выделить,т. к. он превращается в исходные или конечные продукты (по принципу: шарик не удержать на «горке»), то промежуточное соединение, пусть даже неустойчивое, в принципе может быть выделено.
Далее, если возможны два пути реакции 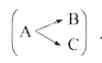 , то реакция идет по
, то реакция идет по
тому пути, где низок энергетический барьер (рис. 3). т. е. вещество А превратится в В (кинетический контроль), несмотря на то, что превращение в С энергетически более выгодно.
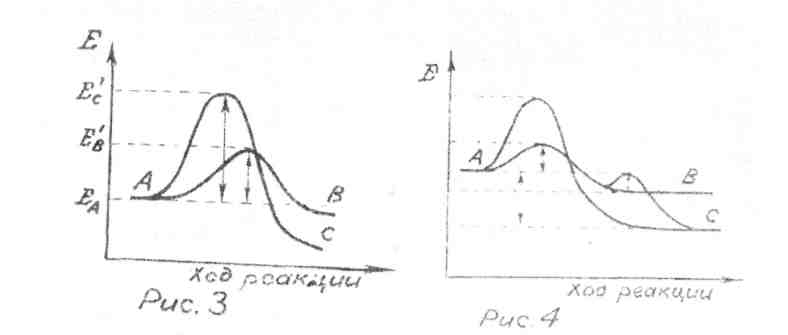
Но, если в системе есть условия для равновесия В ↔ С (или даже В ↔ Е ↔ С с преодолимыми энергетическими барьерами),то конечным продуктом реакции будет вещество С (термодинамический контроль).
Итог: в реакции А → С высокий энергетический барьер преодолен «туннельным способом»(рис. 4).
В этом выражается роль многих катализаторов и ферментных систем, ускоряющих химические реакции иной раз на несколько порядков.
Для полного и глубокого понимания механизмов рассматриваемых в пособии химических превращений необходимо обстоятельно поработать с рекомендуемой литературой.
Дата добавления: 2017-05-02; просмотров: 3367;











