Понятия о типах связей между атомами, валентных состояниях углерода и механизме органических реакций.
Связи между атомами, изображаемые в структурных формулах в виде черточек или палочек (стерженьков), образуются при взаимодействии внешних (валентных) электронов 2-х атомов одной молекулы. По характеру этого взаимодействия различают два основных или крайних типа связей между атомами.
1-ый тип.Ионная, или электровалентная, или солевая связь наиболее ярко (в чистом виде) представлена в случае взаимодействия атома сильного металла (например, щелочного) и атома сильного неметалла (например, галогена). Атом щелочного металла, теряя единственный внешний электрон, становится положительно заряженной частицей, а атом галогена, приобретая один внешний электрон, заряжается отрицательно: Na+ - CI- . Прочность этой связи обусловлена кулоновскими силами притяжения между разнозаряженными частицами и энергией, выделяемой при образовании новой электронной пары у атома галогена. Примерами являются соли органических и неорганических кислот.
2-ой крайний тип.Более характерная для органических соединений ковалентная (или атомная) связьярко (в чистом виде) представлена в 2-х атомных молекулах газов: Н2, O2, N2, С12 и др. в которых связь образована между совершенно одинаковыми атомами. В результате спаривания двух с противоположными спинами электронов двух атомов при их приближении друг к другу выделяется определенное количество энергии (≈ 400 кдж/моль) и новая электронная пара приобретает молекулярную орбиту, занимая в обоих атомах по одной ячейке. Причем наибольшая плотность электронного облака этой пары находится между атомами (происходит как бы перекрывание атомных орбит обоих электронов, рис. а) или образование молекулярной орбиты – рис б).


Рис.1
Хотя изображение б) более близко к истине, правомерны и применяются оба изображения ковалентной связи. В чисто ковалентной связи не происходит никакого отклонения центров положительных и отрицательных зарядов молекулы, они совпадают - молекула неполярна.
Кроме этих 2-х крайних типов связей (ионная и ковалентная) существуют промежуточные типы: 3) полярная, 4) полуполярная, 5) координационная, встречающаяся в основном в так называемых ониевых соединениях (оксониевых, аммониевых, сульфониевых).
В полярной связиэлектронная пара, находящаяся одновременно в поле центров обоих атомов (их ядер), отклонена в сторону более электроотрицательного атома, как например, в молекуле НС1 электронная пара больше находится в ячейке хлора, чем водорода:
Из-за этого отклонения электронной плотности произошло расхождение центров положительных и отрицательных зарядов молекулы. Она стала полярной, обладающей дипольным моментом (т.е. произведением заряда на половину расстояния между зарядами), неравным нулю.
Полуполярная связьнаиболее ярко представлена в кислородных соединениях пятивалентного азота:

Изображение а) хотя допускается, но неправомочно, ибо у атома азота имеется только два электронных уровня (слоя), где на внешнем (2-ом) -слое имеется только четыре ячейки ипять пар электронов (пяти связей) не найдут там места. В связи с этим более верно изображение б), где показан резонанс крайних структур (I и III)и переход к более энергетически выгодной средней структуре. Таким образом, из-за симметричного распределения электронной плотности отрицательный заряд делится на половину между двумя равноценными атомами кислорода. Но в атоме азота на самом деле нет целого положительного заряда, а есть положительный заряд, близкий целому, соответственно, на атомах кислорода (структура П) имеются отрицательные заряды, близкие половине целого заряда.
Координационная связьнаиболее устойчива в соединениях аммония, где атом азота становится четырехвалентным, отдавая протону (а в водной среде катиону гидроксония) один электрон, приобретая положительный заряд (или, другими словами, присоединяя протон к неподеленной паре электронов азота): Н3N: + Н+ → Н4N+
аммиак протон катион аммония
В катионе аммония, образовавшаяся новая связь, видоизменяет природу ранее имевшихся у азота трех других связей N — Н, которые теперь становятся более вытянутыми, и все четыре атома водорода аммония, взаимно отталкиваясь, становятся в самые отдаленные друг от друга положения, а именно по углам правильного тетраэдра при нахождении атома азота в центре этого тетраэдра:

Образовавшаяся новая связь (координационная), ничем не отличается от видоизменившихся связей N — Н, ранее имевшихся в молекуле аммиака. Здесь имеет место s1 р3 - гибридизация четырех оставшихся у азота электронов (как у углерода метана).
Если молекула метана сравнительно прочное образование, не имеющее заряда, то катион аммония (отличающееся от него по строению лишь тем, что ядро центрального атома содержит на один протон и один нейтрон больше) менее устойчив и может легко диссоциировать на аммиак и катион гидроксония, преодолевая определенный энергетический барьер, обуславливающий прочность аммонийных соединений.
Понятие о σ-(сигма) и π-(пи) связях
Ковалентные связи, преобладающие в органических соединениях, в целом определяют химическую активность этих веществ. Однако большое значение имеют непрочные кратные связи (двойные, тройные) и особенности связей в функциональных группах.
Углерод - центральный элемент органического мира, углеродные скелеты (остовы молекул) определяют их устойчивость и практически безграничное их многообразие. Следует потому несколько подробнее рассмотреть электронную природу его связей.
Атом углерода имеет ядро с зарядом +6, и электронную оболочку: 1s2, 2s2, 2р2, где валентными являются четыре внешних электрона (2s2, 2р2). Но, чтобы эти электроны могли образовать четыре связи, 2s2 -электроны, находящиеся в объеме шара в спаренном виде, должны перейти в неспаренное состояние. И возбужденный атом углерода должен иметь оболочку: 1s2, 2s1, 2р3 , где наряду с неспаренным s-электроном (формы шара) имеется три р-электрона (формы объемных восьмерок или гантелей), расположенные по осям координат (х, у, z) трехмерного пространства (рис. 3). Однако, чтобы образоватьчетыре равноценных между собой связи, как в метане, один s-электрон и три р-электрона должны перейти в видоизмененное гибридизированное (s1р3-гибридизация) состояние, причем все четыре внешних электрона уже имеют совершенно одинаковые направленные (гибридные) формы облаков, а атомы водорода метана находятся на равных, наиболее отдаленных друг от друга положениях:
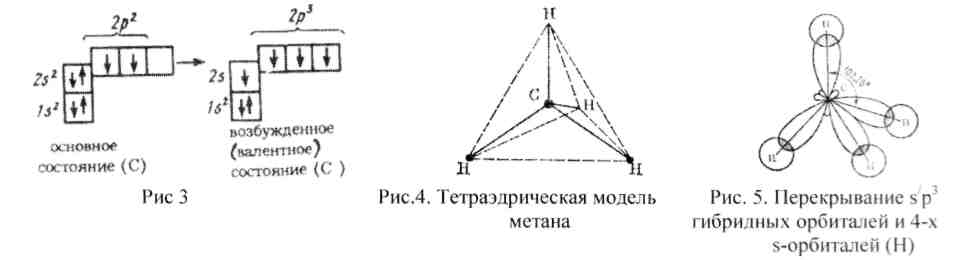
которые соответствуют вершинам правильного тетраэдра, если в центре его поместить атом углерода метана (рис. 4). Состояние углерода, когда имеет место гибридизация валентных электронов в соотношении s1р3, и называется первым валентным состоянием углерода,а связи такого атома с другими атомами называют б(сигма)-связями(рис. 5, 6). 
Таким образом, σ-связь- это любая одинарная связь углерода с другим атомом. И наиболее распространенные в молекулах органических веществ C-H и C-H σ-связь имеют следующие основные данные (рис. 6б, 6в).
С—Н энергия связи ~93-96 ккал/моль (~370-380 кдж/моль).
— длина связи 1,1 А0 (0,11 нм)
С—С энергия связи ~84-86 ккал/моль (~340-360 кдж/моль)
— длина связи 1,54 А0 (0,154 нм)
Второе валентное состояние углеродахарактерно для этилена и других соединений с двойной связью. У углерода этилена имеет место гибридизация валентных электронов возбужденного атома (2s1, 2р3) в соотношении s1p2, когда один р-электрон (из трех) не участвует в гибридизации и остается в р-форме. И гибридные облака направленной (вытянутой) формы располагаются в плоскости под углом друг к другу 120° (рис. 7).

А р-электроны двух углеродов спариваются в р-форме дополнительно к σ-связи между этими углеродами (рис. 7). Вот эта дополнительная (кратная) связь, образованная спариванием электронов в р-форме, и называется π (пи)- связью.Энергия, выделяемая при ее образовании, меньше энергии σ-связи, ибо энергия С = С двойной связи составляет ~140 ккал/моль (~560-580 кдж/моль). Если отсюда отнять энергию С - С σ-связи (~85 ккал/моль), то на π -связь остается ~55 ккал/моль (140-85=55).
Третье валентное состояние углеродахарактерно для ацетилена и других соединений с тройной связью. У углерода ацетилена из четырех валентных электронов (2s1, 2р3) возбужденного атома в гибридизации участвуют по одному s- и р-электрону (s1p1 - гибридизация). И гибридные (вытянутые) два облака располагаются на одной прямой, образуя σ-связи (рис. 8). То есть они занимают наиболее отдаленные положения (z-координату) уже от 2-х оставшихся в р-форме электронов, находящихся по осям координат (х,у) трехмерного пространства, спарившихся в р-форме с образованием двух π -связей во взаимно перпендикулярных плоскостях(рис. 8). Энергия, выделяемая при образовании тройной связи, составляет ~200 ккал/моль. Если отсюда отнять 85 ккал/моль - энергию σ-связи, то на две π-связи остается ~115 ккал/м, т.е. по ~57 ккал/моль на каждую π-связь. Приводим основные характеристики одинарной, двойной и тройной связей для сравнения:
С - С длина связи 1,54 А0, энергия образования связи ~85 ккал/моль
С = С длина связи 1,34 А0, энергия образования связи ~140 ккал/моль
С ≡ С длина связи 1,21 А0, энергия образования связи ~200 ккал/моль Электроны π-связей более объемны, слабее связаны с ядрами атомов, более доступны атаке реагента, легко подвергаются действию электрических и магнитных полей, например, падающего света или атаке заряженных частиц. Поэтому π-связи, обладая совершенно иной природой по сравнению с σ-связями, менее устойчивы и обуславливают высокую химическую активность непредельных соединений по сравнению с предельными (насыщенными) соединениями.
Дата добавления: 2017-05-02; просмотров: 2938;











