РЕАЛЬНЫЕ ГАЗЫ И ПАРЫ
Об особенностях реальных газов по сравнению с идеальными, об уравнении состояния и сложности его использования для инженерных расчетов упоминалось в гл. 1.
Настоящая глава посвящена водяному пару, который широко применяется во многих технологических процессах и, прежде всего, в теплоэнергетике, где он является основным рабочим телом.
5.1. Фазовая p-v-T-диаграмма воды и водяного пара
Рассматривается процесс получения пара из воды, залитой в цилиндр (рис. 5.1).
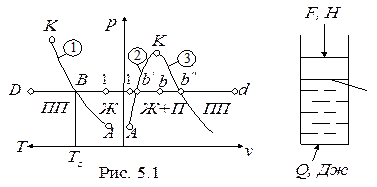
S, м2
Обозначения: 1-линия парообразования; 2- линия кипящей жидкости (нижняя пограничная кривая); 3- линия сухого насыщенного пара (верхняя пограничная кривая); А - тройная точка; К- критическая точка;
Ж– жидкость; П- сухой насыщенный пар; ПП- перегретый пар;
Ts- температура насыщения (температура кипения)
Начальное состояние воды в цилиндре характеризуется давлением p1 = F/S, Н/м2, температурой T1 (точка 1 на диаграммах p-v и p-T ). При подводе тепла Q вода сначала нагревается до температуры кипения (Ts) при p1 = const, затем в процессе кипения при Ts = const и p1 = const преобразуется в пар, который при дальнейшем подводе тепла нагревается до температуры T >Ts.
Обозначения на диаграммах:
1- состояние воды, недогретой до температуры кипения; b¢(B)-кипящая вода (T = Ts, p = p1);
b’' (B) - сухой насыщенный пар (T = Ts, p = p1).
Сухой насыщенный пар имеет температуру, равную температуре насыщения (Ts) при данном давлении.
Мокрый пар - точки b(B) на диаграммах - это смесь кипящей жидкости и сухого насыщенного пара.
Перегретый пар - точки d(D) на диаграммах - имеет температуру выше, чем температура насыщения при данном давлении (T>Ts).
Процесс парообразования (b¢- b¢¢ в p-v- диаграмме) - является изобарно-изотермическим процессом (p1 = const и Ts = const), в котором кипящая вода преобразуется в сухой насыщенный пар (испарение).
Обратный процесс-переход пара в кипящую жидкость называется конденсацией, также является изобарно-изотермическим процессом.
В этих процессах давление и температура взаимосвязаны (Ts = f(p),
ps = f(T)), данная связь на p–T- диаграмме представлена линией парообразования 1,согласно которой с возрастанием давления (p) температура насыщения (Ts) увеличивается.
Таким образом, состояния недогретой до температуры кипения воды и перегретого пара характеризуются двумя независимыми термическими параметрами, например, p и T; состояния кипящей воды, мокрого пара, сухого насыщенного пара - одним термическим параметром p или T.
Тройная точка (состояние А) - это одновременное существование твердой, жидкой и паровой фаз. Параметры тройной точки для воды:
pA = 611 Па, tA = 0,01 0С, vA = 0,001 м3/кг.
Критическая точка (состояние К) - это одновременное существование жидкой и паровой фаз. Для воды параметры критической точки: pkp = 221,15 бар, tkp = 374,12 0С, vkp = 0,003147 м3/кг.
Итак, вода и водяной пар могут находиться в пяти состояниях:
 1. Недогретая до температуры кипения вода (область I, рис. 5.2). Параметры обозначаются следующим образом: p, T, v, h, u, s.
1. Недогретая до температуры кипения вода (область I, рис. 5.2). Параметры обозначаются следующим образом: p, T, v, h, u, s.
2. Кипящая вода (нижняя пограничная кривая 2). Параметры обозначаются так: p, Ts, v¢, h¢, u¢, s¢ или так: T, ps, v¢, h¢, u¢, s.¢
3. Мокрый пар (область II). Параметры обозначаются таким образом: p, Ts, v, h, u, s или ps T, v, h, u, s.
4. Сухой насыщенный пар (верхняя пограничная кривая 3). Параметры обозначаются следующим образом: p, Ts, v¢¢, h¢¢, u¢¢, s¢¢ или T, ps, v¢¢, h¢¢, u¢¢, s¢¢.
5. Перегретый пар (область III). Параметры обозначаются так:
p, T, v, h, u, s.
Выше критической точки (К) находится область однофазных состояний, в которой нельзя провести четкой границы между жидкостью и паром.
Дата добавления: 2021-07-22; просмотров: 525;











