Процессы воды и водяного пара
Для анализа работы паровых двигателей, теплообменного оборудования, паровых теплотрансформаторов (холодильных машин, тепловых насосов) существенное значение имеют изохорный, изобарный, изотермический и адиабатный процессы. Расчет этих процессов можно выполнить либо с помощью таблиц воды и водяного пара, либо с применением h–s- диаграммы. Первый способ более точен, второй – отличается простотой и наглядностью.
Порядок расчета процессов с помощью таблиц воды и водяного пара:
1. Определяется состояние (одно из пяти) воды или водяного пара в начальной точке путем сравнения исходных данных с табличными.
2. Определяются параметры в начальной точке.
3. Определяется состояние в конечной точке.
4. Определяются параметры конечной точки.
5. Рассчитывается теплота и работа процесса.
6. Дается иллюстрация процесса в p- v-, T-s-, h-s- диаграммах.
При определении состояния в начальной и конечной точках сравнивают исходные параметры с табличными (ps, ts, v¢, v¢¢, h¢, h¢¢ , s¢, s¢¢).
Для перегретого пара:
при данном p: 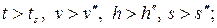
при данной t: 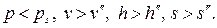
Для недогретой воды:
при данном p: 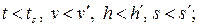
при данной t: 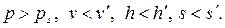
Для мокрого пара:
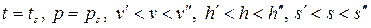 .
.
Для кипящей жидкости:
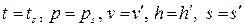 .
.
Для сухого насыщенного пара:
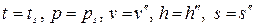 .
.
При использовании h-s- диаграммы параметры в начальной и конечной точках определяются из диаграммы, рассчитываются теплота и работа процесса. Затем дается изображение процесса во всех диаграммах.
Формулы для расчета теплоты и работы в процессах изменения состояния воды и водяного пара получены на основании соотношений:
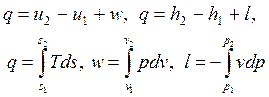 , ,
|
и приведены в табл. 5.1.
Таблица 5.1
| Процесс | Работа, w | Работа, l | Теплота, q |
| Изохорный | w = 0 | l = v(p1 – p2) | q = u2 - u1 |
| Изобарный | w = p(v2 -v1) | l = 0 | q = h2 - h1 |
| Изотермический | w = q-(u2 - u1) | l = q-(h2 - h1) | q = T(s2 - s1) |
| Адиабатный | w = u1 – u2 | l = h1 – h2 | q = 0 |
Особенности расчета изменения параметров, теплоты и работы процессов водяного пара по сравнению с процессами идеального газа состоят в следующем. Для воды и водяного пара:
- не выполняются связи между параметрами, полученные на основе уравнения состояния идеального газа;
- не применима молекулярно-кинетическая теория теплоемкости;
- для изотермического процесса 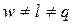 , т.к.
, т.к. 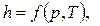
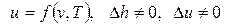 ;
;
- изменение параметров Dh, Du, Ds не рассчитывается по формулам через теплоемкости, а определяется через параметры начальной и конечной точек
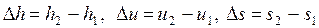 .
.
Изохорный процесс
Дано: p1 =20 бар, v = 0,12 м3/кг, p2 = 3 бар.
Определить: q, w, l.
Расчет процесса с помощью таблиц.
1. При p1 = 20 бар из табл. II [8] находят v¢¢ = 0,09953 м3/кг. Поскольку
v > v¢¢, то начальное состояние – перегретый пар.
Из табл. III определяют параметры h1 = 2976,9 кДж/кг, s1 = 6,6842 кДж/(кг.К), t1 = 280 0С. Внутренняя энергия рассчитывается по формуле
u1 = h1-p1.v = 2976,9-20.102.0,12 = 2736,9 кДж/кг.
2. При p2 = 3 бар из табл.II находят v¢ = 0,001073 м3/кг и v¢¢ = 0,6059 м3/кг. Поскольку v¢ < v < v¢¢, конечное состояние - мокрый пар. Рассчитывают степень сухости
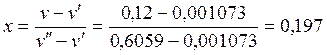 , ,
|
энтальпию, энтропию и внутреннюю энергию мокрого пара:
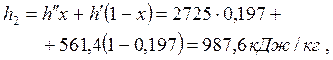
|
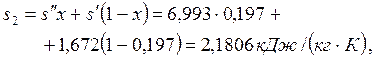
|
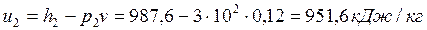 . .
|
3. Рассчитывают теплоту и работу изохорного процесса:
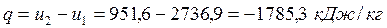 , ,
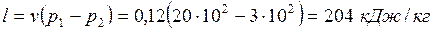 ,
w = 0. ,
w = 0.
|
4. Представляют (строят по исходным данным p1, v, p2) изохорный
процесс в диаграммах p - v, T - s, h - s (рис.5.6-5.8).
 |  |  |
Изобарный процесс
Дано: p = 5 бар, x1 = 0, t2 = 180 0С.
Определить: q, w, l.
Расчет процесса с помощью таблиц.
1. В начальном состоянии рабочее тело – кипящая вода, т.к. x1 = 0. Из табл. II при p = 5 бар находят: h1 = h¢ = 640,1 кДж/кг, v1 = v¢ = 0,001093 м3/кг.
2. В конечном состоянии известны давление p и температура t2. Сравнивают t2 с температурой насыщения при давлении p: ts = 151,8 0С, взятой из табл. II. Поскольку t2 > ts, то конечное состояние – перегретый пар. Из табл.III находят h2 = 2812,1 кДж/кг, v2 = 0,4046 м3/кг.
3. Рассчитывают теплоту и работу изобарного процесса:
q = h2 - h1 = 2172 кДж/кг, w = p(v2 - v1) = 201,8 кДж/кг, l = 0.
4. Строят изобарный процесс по исходным данным (p, x1, t2) в диаграммах p - v, T - s, h - s (рис. 5.9 - 5.11).


5.5.3. Изотермический процесс
Дано: p1 = 10 бар, x1 = 0,9, p2 = 1 бар. Определить: q, w, l.
Дата добавления: 2021-07-22; просмотров: 465;











