Общие определения. Газовые законы
В процессе развития техники и технологии человечество научилось изготавливать тепловые двигатели, в которых механическая работа совершается путем использования теплоты. Превращение теплоты в механическую работу происходит посредством рабочего тела, которым обычно является водяной пар или газ. Изучение основ технической термодинамики целесообразно начать с общих определений и понятий.
Термодинамической системой принято называть тело или совокупность тел, являющиеся объектами исследования. При этом обычно оценивают воздействие, которое оказывает термодинамическая система на окружающую среду или какое влияние окружающая среда оказывает на систему. В термодинамике подобные воздействия сводятся к обмену энергией или веществом между термодинамической системой и окружающей средой.
Термодинамическая система, которая совершенно не взаимодействует с окружающей средой (не обменивается с ней веществом и энергией), называется изолированной или замкнутой.
Термодинамическая система, которая не обменивается с окружающей средой веществом, называется закрытой.
Термодинамическая система, которая обменивается с окружающей средой веществом, называется открытой.
Термодинамическая система, которая не обменивается с окружающей средой энергией в виде теплоты, называется адиабатной.
Термодинамическим равновесием называется состояние, когда при неизменных внешних условиях параметры системы не меняются во времени и отсутствуют потоки вещества и энергии между системой и окружающей средой. Изолированная система с течением времени всегда приходит в состояние термодинамического равновесия и самостоятельно выйти из него не может. В равновесном состоянии система может находиться как угодно долго, пока какие-нибудь внешние воздействия не выведут систему из этого состояния.
Термодинамический процесс – это изменение состояния системы, которое возникает в ней под влиянием внешних воздействий. Всякий термодинамический процесс может возникнуть только при нарушении состояния термодинамического равновесия. Термодинамический процесс сопровождается изменением всех или части параметров системы.
Свойство процессов одинаково идти в противоположных направлениях называется обратимостью.
Газы, используемые в тепловых установках, характеризуются различными физическими свойствами. Молекулы газов имеют конечный объем, между нами существуют силы взаимодействия. Молекулы газа находятся в непрерывном хаотическом движении, при этом они сталкиваются друг с другом и со стенками сосуда. Таким образом, молекулы обладают кинетической энергией движения. Молекулы также обладают потенциальной энергией взаимодействия, зависящей от расстояния между ними. Эти процессы и обстоятельства и определяют свойства реальных газов.
Для упрощения изучения свойств газообразного рабочего тела было введено понятие идеального газа. Идеальный газ – это такой воображаемый газ, молекулы которого рассматриваются как материальные точки, имеющие массу, но не имеющие размеров, между которыми отсутствуют силы взаимодействия (за исключением моментов непосредственного столкновения).
При больших объемах и малых давлениях, когда расстояния между молекулами во много раз больше размеров самих молекул, а также при высоких температурах, когда интенсивность хаотического движения молекул велика и поэтому молекулы слабо взаимодействуют друг с другом, складываются условия, при которых вместо реального газа можно с достаточным приближением использовать модель идеального газа.
Наиболее важными параметрами, характеризующими газообразные тела, являются их давление, температура и удельный объем.
Давление. В результате своего хаотического движения молекулы газа систематически ударяются о стенки сосуда, в котором этот газ находится. Суммарное действие всех многочисленных ударов молекул о стенки и определяет силу давления газа на стенки сосуда. Собственно давлением называется величина, численно равная силе, действующей по нормали к поверхности стенки сосуда, отнесенной к единице площади этой поверхности.
Давление газа измеряется в тех же единицах, что и давление жидкости (в Па) и измеряется теми же приборами.
Температура. Температура является мерой средней кинетической энергии хаотического движения молекул. Чем интенсивнее движутся молекулы, то есть, чем больше их кинетическая энергия, тем выше температура газа.
Существуют различные единицы измерения температуры и соответствующие им температурные шкалы. В Международной системе единиц (СИ) для измерения температуры принят градус Кельвина (°К). Шкала Кельвина берет свое начало от абсолютного нуля температур (0 °К).
Допускается к использованию и температурная шкала Цельсия с ценой деления градус Цельсия (°С). По шкале Цельсия отсчет производится от точки плавления воды (0 °С). Как известно, по шкале Цельсия температура абсолютного нуля – минус 273 °С. При этом один градус Кельвина по термодинамической шкале равен одному градусу по шкале Цельсия. Поэтому связь температур по шкале Цельсия (t) и Кельвина (T) имеет вид
T = t + 273.
Удельный объем. Этот параметр представляет собой объем 1 кг вещества
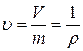 ,
,
где 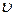 – удельный объем вещества,
– удельный объем вещества, 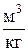 ;
;
V – объем, занимаемый газом, м3;
m – масса газа, кг;
ρ – плотность газа, 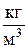 .
.
В технической термодинамике часто используется понятие моль или киломоль (кмоль). Киломоль – это количество вещества в килограммах, численно равное его молекулярной массе. Таким образом, киломоль вещества с молекулярной массой μ весит μ кг, а m кг вещества содержат 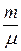 киломолей.
киломолей.
Закон Авогадро
Для идеального газа справедливо утверждение, называемое законом Авогадро: все газы при одинаковых давлении и температуре содержат в равных объемах одинаковое число молекул. При этом массы этих одинаковых объемов газов будут разными, зависящими от молекулярной массы. Тогда справедливо соотношение
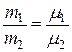 ,
,
где m1 и m2 – массы равных объемов различных газов, 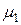 и
и 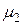 – их молекулярные массы соответственно.
– их молекулярные массы соответственно.
Разделив левую часть этого соотношения на объем газа V, получим
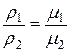 ,
,
где 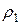 и
и 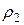 – плотности газов.
– плотности газов.
Так как удельный объем газа определяется как 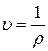 , то получаем
, то получаем
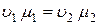 , ,
| (1) |
то есть, произведение удельного объема на молекулярную массу постоянно для всех газов, находящихся в одинаковых условиях – при одинаковых давлении и температуре.
Дата добавления: 2017-04-05; просмотров: 1711;











