Уравнение состояния идеального газа
Равновесное состояние идеального газа как термодинамической системы определяется его параметрами: температурой T, давлением p и удельным объемом 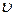 . Между этими параметрами существует связь, которая выражается уравнением состояния. Уравнение состояния идеального газа имеет вид:
. Между этими параметрами существует связь, которая выражается уравнением состояния. Уравнение состояния идеального газа имеет вид:
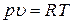 . .
| (2) |
Здесь R – газовая постоянная, 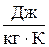 ;
;
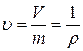 – удельный объем вещества.
– удельный объем вещества.
Это уравнение записано для массы идеального газа, равной 1 кг, и носит название уравнения Клапейрона.
Для одного киломоля газа уравнение (2) запишется так:
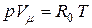 , ,
| (3) |
где Vμ – объем одного киломоля газа при данных условиях, R0 – универсальная газовая постоянная, одинаковая для одного киломоля любого газа:
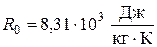 .
.
Для произвольной массы газа m с молекулярной массой μ уравнение (3) запишется в виде
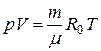 , ,
| (4) |
где V – объем, занимаемый m кг газа, 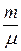 – число киломолей газа.
– число киломолей газа.
Уравнение (4) можно записать также в виде
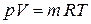 . .
| (5) |
Газовая постоянная R связана с универсальной газовой постоянной R0 соотношением
 . .
| (6) |
Уравнения (2) и (5) называются характеристическими, поскольку с их помощью можно характеризовать состояние идеального газа.
Смесь газов
В природе и в технике очень часто встречаются различные смеси газов. Например, воздух представляет собой смесь газов (азот, кислород, углекислый газ и др.), различные горючие газы, представляют собой смесь углеводородов (пропана, бутана, метана, пентана и др.), продукты горения, состоят из смеси газов (углекислый газ, азот, окись углерода и др.).
Поэтому важно понять закономерности, которым подчиняются смеси газов.
Если различные компоненты газовой смеси не вступают между собой в химические реакции, то каждый газ равномерно распределяется по всему объему сосуда. Давление, которое оказывает каждый газ в смеси, называется парциальным. То есть, парциальное давление газа в смеси равно давлению, которое будет, если этот газ один занимает весь объём смеси при той же температуре. Его можно определить по температуре и объему смеси на основании характеристического уравнения (5) для данного газа.
По закону Дальтона, давление, оказываемое смесью газов, равно сумме парциальных давлений отдельных газов, входящих в состав смеси:
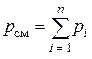 .
.
Смесь газов ведет себя как однородный газ и его состояние можно описать характеристическими уравнениями
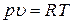
| – для одного килограмма газовой смеси; |
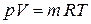
| – для m кг смеси; |
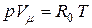
| – для одного киломоля смеси. |
Однако для использования этих уравнений необходимо знать газовую постоянную смеси либо молекулярную массу смеси, связанную с газовой постоянной соотношением
 .
.
Эти величины зависят от количественного и качественного состава газовой смеси. При этом состав смеси может быть задан в массовых или объемных долях.
Массовая доля представляет собой отношение массы компонента к массе всей смеси:
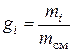 .
.
Объемная доля представляет собой отношение объема компоненты смеси при давлении смеси к объему всей смеси:
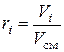 .
.
Чтобы применить уравнение Клапейрона для смеси идеальных газов необходимо вычислить газовую постоянную смеси Rсм или молекулярную массу смеси μсм.
Существуют два способа расчета этих величин: массовый и объемный.
Если задан массовый состав смеси, то есть, заданы массовые доли каждого газа в смеси, тогда
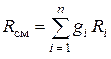 .
.
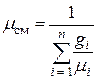 .
.
Если задан объемный состав смеси, то есть, заданы объемные доли каждого газа в смеси, тогда
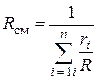 .
.
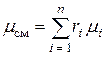 .
.
Массовые и объемные доли связаны между собой
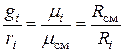 .
.
После определения Rсм и μсм смесь можно рассматривать как однородный газ с соответствующими характеристиками.
Дата добавления: 2017-04-05; просмотров: 2345;











