А. Оптическая изомерия
Наибольшее распространение у моноз получила оптическая изомерия, обусловленная наличием асимметрического углеродного атома. Монозы имеют в своем строении несколько асимметричных атомов углерода. При наличии в молекуле «n» асимметричных атомов углерода число пространственных изомеров будет равно 2n.Так как молекулы моносахаридов построены несимметрично, для них не существует оптически неактивных мезо-форм. Для альдопентозы N = 23 или 8 ( 4 D – ряда и 4 L – ряда), для альдогексоз N = 24 или 16 ( 8 D – ряда и 8 L – ряда), для кетогексозы N = 23 или 8 ( 4 D – ряда и 4 L – ряда).
Как известно, оптические изомеры принадлежат либо к D – ряду, либо к L – ряду. Эталоном служат оптические антиподы глицеринового альдегида. Принято следующее условие: вещества, которые можно получить из D- глицеринового альдегида путем надстройки углеродной цепи со стороны альдегидной группы, относятся к D – ряду. Аналогичное положение применимо и к L – ряду. Очевидно, что при любой надстройке углеродной цепи неизменной остается группировка двух нижних углеродных атомов глицеринового альдегида:
 | |||
 | |||

 Н – С* – ОН ОН – С* – Н
Н – С* – ОН ОН – С* – Н
СН2ОН СН2ОН
группировка D – глицеринового группировка L – глицеринового
альдегида альдегида
Все альдозы D-ряда до альдогексоз включительно можно получить из D – глицеринового альдегида путем надстройки углеродной цепи со стороны альдегидной группы. Перед названием монозы в скобках указывается знак вращения плоскости поляризации, который не всегда соответствует принадлежности правого вращения (+) к D – ряду, то есть правой конфигурации монозы, а левое вращение ( – ) к L – ряду, то есть левой конфигурации монозы. Отсюда, для установления конфигурации молекулы важной характеристикой является ориентация НО – группы у последнего асимметричного углеродного атома, а не знак вращения поляризованного луча света.
Номенклатура моноз
Для углеводов обычно используют тривиальные названия с характерным окончанием – оза.Диастереомеры имеют различные названия, что подчеркивает различие их свойств. Зеркальные изомеры имеют одинаковые названия, отличающиеся символами D и L, например D – глюкоза, L – глюкоза.
Согласно систематической или ЮПАК номенклатуре названия кетоз содержат буквосочетание – улоза, например рибулоза.
Если альдозы различаются только конфигурацией атомов у второго углеродного атома, их называют эпимерами, например глюкоза и манноза.
Часто вместо структурных формул моносахара изображают проекционными формулами Фишера:

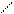
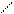
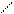
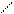
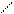
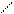
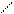
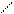
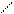
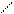
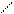
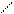 О О О О О О
О О О О О О











 1С С С С С С
1С С С С С С
Н Н Н Н Н Н





 Н 2 ОН НО Н Н ОН НО Н Н ОН Н ОН
Н 2 ОН НО Н Н ОН НО Н Н ОН Н ОН





 НО 3 Н Н ОН НО Н НО Н НО Н НО Н
НО 3 Н Н ОН НО Н НО Н НО Н НО Н





 Н 4 ОН НО Н Н ОН Н ОН Н ОН НО Н
Н 4 ОН НО Н Н ОН Н ОН Н ОН НО Н





 Н 5 ОН НО Н Н ОН Н ОН Н ОН Н ОН
Н 5 ОН НО Н Н ОН Н ОН Н ОН Н ОН
6СН2ОН СН2ОН СН2ОН СН2ОН СН2ОН СН2ОН
D -глюкоза L – глюкоза D - глюкоза D - манноза D - глюкоза D – галактоза
 |  |  | |||||||||
 |  |  | |||||||||
антиподы эпимеры (диастереомеры) диастереомеры


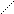
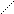
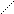
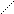



 1СН2ОН СН2ОН 1СН2ОН СН2ОН О О
1СН2ОН СН2ОН 1СН2ОН СН2ОН О О







 2С = О С = О 2С = О С = О С 1С
2С = О С = О 2С = О С = О С 1С



 НО–3С*– Н Н –*С – ОН НО 3 Н Н ОН Н Н
НО–3С*– Н Н –*С – ОН НО 3 Н Н ОН Н Н





 Н–4С*– ОН НО–*С – Н Н 4 ОН НО Н Н –*С – ОН 2 СН2
Н–4С*– ОН НО–*С – Н Н 4 ОН НО Н Н –*С – ОН 2 СН2





 Н–5С*– ОН НО–*С – Н Н 5 ОН НО Н Н –*С – ОН Н–3С – ОН
Н–5С*– ОН НО–*С – Н Н 5 ОН НО Н Н –*С – ОН Н–3С – ОН

 6СН2ОН СН2ОН 6СН2ОН СН2ОН Н –*С – ОН Н–4С – ОН
6СН2ОН СН2ОН 6СН2ОН СН2ОН Н –*С – ОН Н–4С – ОН
СН2ОН 5СН2ОН
D – фруктоза L – фруктоза D- фруктоза L- фруктоза D – рибоза D -2-дезоксирибоза
Приведенные линейные формулы углеводов не выражают строения моносахаридов, так как не согласуются с их химическими и физико-химическими свойствами. Так при действии на глюкозу йодистого метила получают пентаметилглюкозу, следовательно, реагируют пять гидроксильных групп. При действии другого метилирующего агента, метилового спирта в соляной кислоте, реагирует только один гидроксил глюкозы. Алкилирование глюкозы и фруктозы приводит к исчезновению альдегидных и кетонных свойств. Эти и другие данные позволяют приписать глюкозе и фруктозе формулы полуацеталей.
Полуацетали образуются при взаимодействии δ- ОН группы линейной формулы монозы с ее С = О – группой. В общем виде это выглядит следующим образом:
 |

 Oδ–
Oδ–


 R – Cδ+ + Hδ+ – δ– OR' R – CH – OН
R – Cδ+ + Hδ+ – δ– OR' R – CH – OН
H OR'
полуацеталь
Таким образом, в моносахаридах происходит оксо-циклотаутомерия или кольчато-цепная таутомерия:




 НО Н Н ОН
НО Н Н ОН


 С Н – Сδ+ = Оδ– 1С*
С Н – Сδ+ = Оδ– 1С*




 Н ОН Н α ОН Н ОН
Н ОН Н α ОН Н ОН





 НО Н О НО β Н НО Н О
НО Н О НО β Н НО Н О


 Н ОН Н γ ОН Н ОН
Н ОН Н γ ОН Н ОН


 Н Н δ Оδ– Нδ+ Н
Н Н δ Оδ– Нδ+ Н
СН2ОН СН2ОН СН2ОН
β – D – глюкоза D – глюкоза α – D – глюкоза
β –аномер α –аномер
Появляется новый гидроксил у первого углеродного атома. Этот гидроксил обладает особыми свойствами и называется гликозидным или полуацетальным гидроксилом. Первый углеродный атом становится асимметрическим, у которого возможны два положения гликозидного гидроксила, а именно, со стороны кольца – и это будет α-аномер, и с противоположной стороны кольца – и это будет β-аномер. Число оптических изомеров возрастает, и, исходя из формулы N = 2n , оно будет равным 25 или 32, где будут учитываться α и β аномеры D - и L – рядов.
Пространственная сближение НО-группы у 5-го атома углерода в тетраэдрической конфигурации с карбонильной группой у альдегидного атома углерода благоприятствует образованию внутреннего циклического полуацеталя и возникновению шестичленного ненапряженного цикла, состоящего из пяти атомов углерода и одного атома кислорода. Такой цикл называется пиранозным, так как соответствует названию подобного гетероцикла пирана
СН2 – СН2 


 СН2 О,
СН2 О,
СН2 – СН2
а монозы называются, соответственно, пиранозами. Поэтому циклическую шестичленную глюкозу называют глюкопираноза. Пятичленные циклы называют фуранозами от гетероцикла фурана:

 СН2 – СН2
СН2 – СН2
 О.
О.
СН2 – СН2
Проекционные формулы Фишера фруктозы:
Циклические формы фруктозы образуются либо за счет НО-группы у 5-ого углеродного атома, либо за счет НО-группы у 6-ого атома углерода:


 СН2ОН СН2ОН СН2ОН
СН2ОН СН2ОН СН2ОН


 С – ОН С = О С – ОН
С – ОН С = О С – ОН






 НО Н НО Н НО Н
НО Н НО Н НО Н



 Н ОН О Н ОН Н ОН О
Н ОН О Н ОН Н ОН О



 Н Н ОН Н ОН
Н Н ОН Н ОН
 СН2ОН СН2ОН СН2
СН2ОН СН2ОН СН2
α – D – фруктофураноза D – фруктоза α – D – фруктопираноза
(пятичленный цикл) (открытая форма) (шестичленный цикл)
Для более реального изображения моносахаридов как циклических полуацеталей используют так называемые перспективные формулы Хеуорзса, в которых кольца изображают в виде правильных пяти - и шестиугольников, расположенных перпендикулярно плоскости чертежа, а заместители располагаются над и под плоскостью цикла. При переходе от проекционных формул Фишера к перспективным формулам Хеурзса атомы и группы атомов, расположенные в проекционной формуле слева, следует писать наверху, а расположенные справа – внизу.
Например, кольчато – цепная таутомерия глюкозы в виде формул Хеурзса будет выглядеть следующим образом:


 СН2ОН СН2ОН СН2ОН
СН2ОН СН2ОН СН2ОН












 Н О ОН Н ОН Н О Н
Н О ОН Н ОН Н О Н





 Н Н О Н
Н Н О Н






 ОН Н ОН Н С ОН Н
ОН Н ОН Н С ОН Н


 ОН Н ОН Н НО ОН
ОН Н ОН Н НО ОН
Н ОН Н ОН Н ОН
β -D –глюкопираноза D – глюкоза α – D – глюкопираноза
Кольчато-цепная таутомерия фруктозы в виде формул Хеуорзса:
 |









 НОСН2 О ОН СН2ОН Оδ– Нδ+ СН2ОН НОСН2 О СН2ОН
НОСН2 О ОН СН2ОН Оδ– Нδ+ СН2ОН НОСН2 О СН2ОН











 Н ОН Сδ+ = Оδ–
Н ОН Сδ+ = Оδ–
 СН2ОН Н Н ОН
СН2ОН Н Н ОН
Н ОН Н ОН Н ОН Н
β - D – фруктофураноза D – фруктоза α – D – фруктофураноза
Изучение свойств моноз привело к выводу, что в кристаллическом состоянии эти вещества существуют исключительно в форме полуацеталей в виде α – или β – аномеров. При химических реакциях полуацетали частично переходят в открытые или цепные формы, что объясняется их таутомерией в растворах. При растворении одной из пиранозных форм моносахарида в воде или диметилформамиде (ДМФА) происходит частичное превращение его в другой аномер как в пиранозной, так и фуранозной формах вплоть до установления равновесия.
В настоящее время методом ЯМР-спектроскопии установлен состав равновесных таутомерных смесей некоторых моноз.
Изменение оптической активности растворов моноз во времени с установлением равновесных таутомерных смесей моноз называется мутаротацией. Например, удельное вращение растворов α- D- глюкопиранозы равно +112,2о, а β-D- глюкопиранозы равно +18,7о. Со временем достигается постоянное значение удельного вращения раствора, равное +52,7о , вследствие образования равновесной системы:
 + 112,20 + 52,70 + 18,70
+ 112,20 + 52,70 + 18,70
α – D – глюкопираноза смесь таутомеров β – D –глюкопираноза
α – аномеров ≈ 64%,
β – аномеров ≈ 36%
В растворах некоторых моносахаридов обнаружены и фуранозные формы, например глюкозы.
Дата добавления: 2017-01-16; просмотров: 3740;











