Введение, номенклатура, изомерия.
Старшинство заместителей и обозначение их в приставках и суффиксах:
Заместители в таблице расположены по возрастанию старшинства.
| Заместитель | приставка | суффикс |
| СН3-; СnH2n+1- | метил-; (алкил-) | - |
| СºС- | этинил- | -ин |
| С=С- | этенил- | -ен |
| NO2- | нитро- | - |
| NH2- | амино- | -амин |
| F-, Cl-, Br-, J- | хлор- (пример) | -хлорид (пример) |
| OH- | окси- | -ол |
| -C=O | оксо- | -он |
| -CHO | оксо- | -аль |
| -CºN | циано- | -нитрил |
| -COOH | карбокси- | -овая кислота |
по правилам IUPAC названия органических соединений строятся по следующим основным правилам:
- Выбирается самая длинная углеродная цепь, содержащая наибольшее количество разветвлений и заместителей и называется отдельно с использованием соответствующего числительного.
- Атомы углерода этой цепи нумеруются так, чтобы самый старший заместитель был присоединен к углеродному атому с меньшим номером и сумма порядковых номеров атомов углерода, содержащих заместители, была наименьшей.
- Каждому заместителю присваивается числительное соответствующее порядковому номеру атома углерода основной цепи. Цифра, указывающая положение заместителя, отделяется черточкой. При наличии в молекуле двух или более одинаковых заместителей в названии, они группируются и прибавляется соответствующая приставка ди-, три- и т.д. Например: 2,2,4-триэтил-.
- При составлении полного названия заместители располагают в алфавитном порядке до названия основной цепи. В русском названии используется русский алфавит, в английском - латинский. Все цифры в названии отделяются от текста названия черточками с обеих сторон. Все остальное пишется слитно. Только самый старший заместитель и указатели кратности углеродных связей (см. таблицу) располагаются в названии после основной цепи - в суффиксе.
Пример:
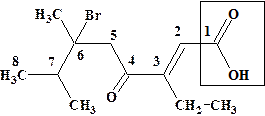
6-бром-6,7-диметил-4-оксо-3-этилоктен-2-овая кислота
Типы реакций в органической химии:
Разрав (образование) связи:
Гомолитический разрыв, образование радикалов (нейтральных частиц с неспаренным электроном).
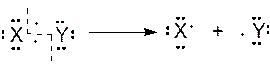
Образование связи путем рекомбинации свободных радикалов (встречается достаточно редко по причине нестабильности (малого времени жизни) свободных радикалов, главным образом в качестве побочного процесса в цепных радикальных реакциях см. ниже)
Гетеролитический разрыв, образование пары ионов.
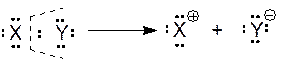
Типы химических реакций:
1. Присоединение (Ad)

2. Замещение (S)
Нуклеофильное (SN)
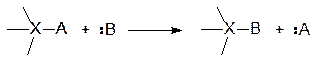
Электрофильное (SE)
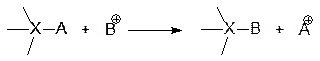
3. Элиминирование (отщепление) (E) Процесс обратный реакции присоединения.
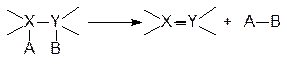
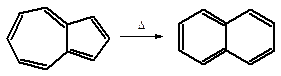
4. перегруппировка - изменение структуры углеродного скелета молекулы или ее фрагмента без изменения брутто-формулы. Например перегруппировка азулена в нафталин:
Изомерия.
Изомеры – химические соединения, имеющие одинаковый количественный состав (имеют одинаковую брутто-формулу).
Подразделяют следующие типы изомерии (по возрастанию схожести молекул):
1. Изомерия классов соединений. Физические (температуры кипения и плавления, теплоемкость, плотность и т.п.) и химические свойства различны.
Пример: С4Н10О бутанол (спирт) и диэтиловый эфир (простой эфир).
2. Изомерия положения заместителей (частный случай – изомерия углеродного скелета). Физические свойства различны, многие химические свойства близки, но, как правило, существуют различия в реакционной способности и скоростях протекания реакций с участием соответствующих изомеров.
Пример: С4Н10О н-бутиловый, изо-бутиловый, втор-бутиловый и трет-бутиловый спирты; С7Н7Cl о-, м- и п-хлортолуолы; С4Н10О Диэтиловый и метилпропиловый эфиры.
3. Пространственная изомерия
3а изомерия положения заместителей при двойной связи – цис/транс или Z/E изомерия. Физические свойства немного различны, химические свойства отличаются не значительно.
Пример: Транс- и цис-2-бром-3-хлорбутены-2 соответственно.
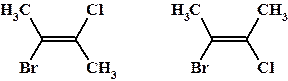
Наличие изомеров обусловлено высоким энергетическим барьером вращения вокруг кратной связи. Термически возможно осуществить переход от менее термодинамически выгодного цис-изомера, к более устойчивому – транс-.
3б Оптическая изомерия (хиральность). В общем случае, изомеры являющиеся зеркальным отражением друг друга, но не способными с помощью операций симметрии совместится. Возможна точечная хиральность (в молекуле содержится один или несколько атомов углерода содержащих четыре разных заместителя), осевая или линейная хиральность (левая и правая спираль с разными концами). Физические свойства одинаковы, кроме способности вращать плоскость плоско-поляризованного света (это свойство присуще только хиральным соединениям и связано с разницей во взаимодействии хиральной молекулы с двумя циркулярными составляющими плоско-поляризованного света). Химические свойства одинаковы, кроме случаев взаимодействия с хиральныи же молекулами.
На этом последнем свойстве основаны методы разделения рацемических смесей хиральных соединений (R:S=1:1). При взаимодействии рацемической смеси с одним изомером реагента образуются продукты, проявляющие разные физико-химические свойства. Их разделяют с помощью различных методов, а затем регенерируют исходные вещества. Это же свойство используют при проведении стереоселективных превращений органических соединений. Либо используют заведомо чистый оптическиактивный субстрат и применяют реакции, позволяющие сохранить или обратить конфигурацию субстрата, либо при использовании рацемических или нехиральных субстратов используют хиральные катализаторы, добавки или растворители.
Пример: R- и S-1-бром-1-фтор-1-хлорэтаны
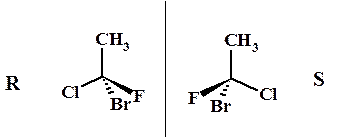
По правилам номенклатуры ИЮПАК абсолютные конфигурации точечного оптического (хирального) центра определяют по направлению убывания молекулярной массы трех старших заместителей при этом самый младший заместитель направлен от наблюдателя. Если убывание по часовой стрелке – то R, если против – то S. Правила старшинства заместителей аналогичны используемым в определении Z/E изомеров.
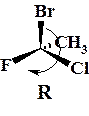
Большинство органических молекул встречающихся в биологических объектах имеют один или несколько оптических (хиральных) центров. Причем, как правило, в природе встречается исключительно один из двух или нескольких изомеров.
Для некоторого упрощения описания строения хиральных молекул была введена т.н. относительная конфигурация (D/L номенклатура) и проекции Фишера. За основу был взят глицериновый альдегид.
Пример: переход от клиновидной проекции D-глицеринового альдегида (R-абсолютная конфигурация) к проекции Фишера.
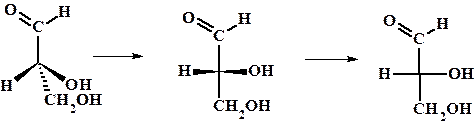
Для L-глицеринового альдегида гидроксильная группа будет располагаться слева.

| <== предыдущая лекция | | | следующая лекция ==> |
| Области знания первобытного общества | | | Стационарные поворотные краны. |
Дата добавления: 2016-06-15; просмотров: 2248;











