Коэффициент активности и ионная сила
Заряженные частицы (ионы) в растворе взаимодействуют друг с другом за счет электростатических сил, что приводит к существенному отличию свойств реальных растворов от идеальных, где такое взаимодействие отсутствует. Каждый ион в растворе окружен так называемой «ионной атмосферой», которая состоит из частиц противоположного знака и плотность которой зависит как от заряда иона z, так и от ионной силы раствора I (присутствия всех заряженных частиц в растворе). Наличие такой «ионной атмосферы» и приводит к тому, что свойства реальных растворов определяет не общая концентрация иона, а ее активная часть, которую называют активностью (а). Активность связана с общей концентрацией иона формальным соотношением:
ai = γi∙сi , где: γi – коэффициент активности иона.
Коэффициенты активности могут быть меньше единицы или равны единице, в зависимости от концентрации раствора, заряда иона и присутствия других заряженных частиц в растворе, поэтому активность может быть больше, меньше или равна концентрации.
Для расчета ионной силы раствора обычно используют выражение:
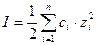
где: ci – молярная концентрация иона, моль/л;
zi – заряд иона
При расчете ионной силы раствора вклад слабых электролитов не учитывается, так как он незначителен.
Зная заряд иона и ионную силу раствора можно по специальным таблицам определить коэффициент активности данного иона в воде при 250С, либо рассчитать его по уравнениям Дебая-Хюккеля:
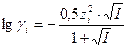 , при 0,01 < I < 0,1
, при 0,01 < I < 0,1
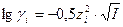 , при I < 0,01
, при I < 0,01
 Например, коэффициенты активности ионов натрия и сульфатных ионов в 0,01 М растворе Na2SO4 в 0,05 М ацетатном буфере (0,05 М CH3COOH + 0,05 M CH3COONa) можно рассчитать следующим образом (при расчете ионной силы вклад слабой уксусной кислоты не учитывается):
Например, коэффициенты активности ионов натрия и сульфатных ионов в 0,01 М растворе Na2SO4 в 0,05 М ацетатном буфере (0,05 М CH3COOH + 0,05 M CH3COONa) можно рассчитать следующим образом (при расчете ионной силы вклад слабой уксусной кислоты не учитывается):
I = 0,5∙(2∙0,01∙12 + 0,01∙22 + 0,05∙12 + 0,05∙12) = 0,08
В сильно разбавленных растворах (сi → 0), в которых ионная сила мала (I → 0), коэффициент активности γi → 1 и аi → сi, то есть свойства бесконечно разбавленных растворов приближаются к свойствам идеальных растворов.
Дата добавления: 2017-04-05; просмотров: 3138;











