Зависимость теплового эффекта реакции от температуры
Энтальпия является функцией температуры, непрерывной в области изменения последней. Зависимость изменения энтальпии (теплового эффекта) химической реакции от температуры выражается уравнениями
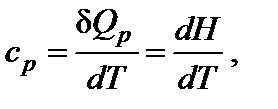
где cp – теплоемкость при постоянном давлении (изобарная теплоемкость).
Чтобы найти изменения внутренней энергии или энтальпии вещества при изменении температуры системы от Т1 до Т2, необходимо интегрировать соответствующее уравнение. С практической точки зрения большее значение имеют химические процессы, протекающие в изобарных условиях, тепловой эффект которых рассчитывают через изменение энтальпии. Если в интервале от 298 К до температуры Т К нет фазовых переходов, то изменение энтальпии образования вещества составит
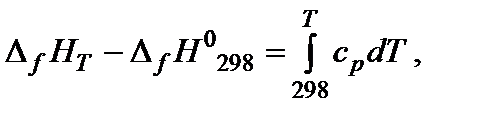
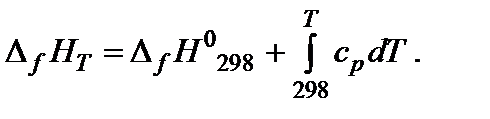
Если в температурном интервале имеются фазовые переходы, то при расчете необходимо учитывать изменение энтальпии вещества при фазовом переходе. Например, изменение энтальпии одного моля воды при изобарном нагревании от Т1 <0°С, до Т2 > 100°С можно представить в виде
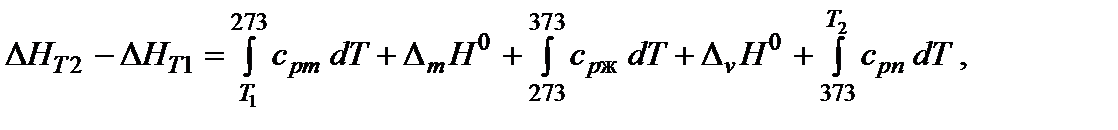
где DmН0 [кДж/моль] – энтальпия плавления (melting – плавление); DvН0 [кДж/моль] – энтальпия испарения (vaporization – испарение),
cpi – изобарная теплоемкость фазы, соответствующая диапазону температур.
Для не слишком широких интервалов температур можно считать, что теплоемкость не зависит от температуры (Ср = const). Значения молярных изобарных теплоемкостей Cр 298 веществ приведены в справочниках.
Кроме справочных таблиц (баз данных) по энтальпиям (теплотам) образования химических соединений, составлены также (особенно для органических веществ) аналогичные таблицы по теплотам (энтальпиям) сгорания (∆сH0298A, где индекс «с» – от combustion, сгорание).
Таким образом, мы рассмотрели первую задачу, которую поставили при начале обсуждения темы, – задачу об энергетике химических реакций.
Дата добавления: 2019-09-30; просмотров: 266;










