Расчет электрохимической коррозии
Коррозионные потери металла пропорциональны величине коррозионного тока:
∆m=KI, (4.72)
где: ∆m – потери массы металла, K – коэффициент, I – величина коррозионного тока, связанная со скоростью коррозии уравнением (1.11).
Методы расчета коррозионного процесса делятся на аналитические и графические. При аналитическом расчете установившуюся величину коррозионного тока можно определить на основании закона Ома для гальванического элемента:
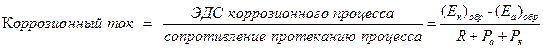 , (4.72)
, (4.72)
где [(Ek)обр и (Ea)обр – обратимые потенциалы катодного и анодного процессов соответственно; R – омическое сопротивление (электролита и металла) коррозионной системы; Pa и Pk – анодная и катодная поляризуемость соответственно (сопротивление протеканию коррозии, вызванного торможением анодного и катодного процесса).
Для большинства коррозионных систем омическое сопротивление невелико по сравнению с (Pa+Pk), т.е. R<< Pa+Pk. Поэтому максимальный коррозионный ток:
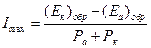 (4.73)
(4.73)
Числитель уравнений (4.72) и (4.73) можно определить, рассчитав обратимые потенциалы, поляризуемости же анодного и катодного процессов в виде аналитической зависимости от тока Pa, Pk=f(I) можно приближенно оценить для простых случаев.
1) Для очень малых плотностей коррозионного тока, в области линейной зависимости:
Еа = (Еа)обр +ΔЕа = (Еа)обр + к1ia, (4.74)
Еk = (Еk)обр –ΔЕk = (Еk)обр – к2ik , (4.75)
R≈const, (4.76)
где: k1 и k2 – коэффициент пропорциональности.
Поскольку анодная и катодная плотности тока различны вследствие разных площадей анодных и катодных участков поверхности корродирующего металла:
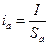 ,
, 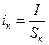 ; (4.77)
; (4.77)
то 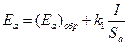 , (4.78)
, (4.78)
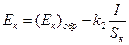 , (4.79)
, (4.79)
где: 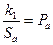 ,
, 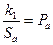 .
.
Отсюда 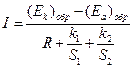 (4.80)
(4.80)
2) При больших плотностях тока с логарифмической зависимостью поляризации от плотности тока (этот случай встречается чаще):
Еa = (Еa )обр + ΔЕа = (Еa )обр + (аа + bа lniа), (4.81)
Ек = (Ек )обр - ΔЕк =(Ек )обр - (ак + bк lniк ), (4.82)
R ≈ соnst.
При подстановке в уравнение (4.73) получается система уравнений, которые достаточно просто решаются графическими методами.
Пример 4.5. Элемент металлической конструкции состоит из участка поверхности цинка, в котором сделано отверстие и запрессована медная заклепка радиусом 8,03 мм. Рассчитать максимальную силу локального тока пара Сu-Zn в охлаждающем рассоле на основе водного 0,5н раствора NaCl при 293К если концентрация кислорода С 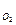 = 2,25.10-7 г-моль/см3, коэффициент диффузии кислорода в данном растворе D
= 2,25.10-7 г-моль/см3, коэффициент диффузии кислорода в данном растворе D 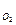 =1,95.10-5 см2/с, толщина диффузионного слоя δd = 0,075 см. Сопоставить полученную величину с экспериментальным значением I = 52 мкА.
=1,95.10-5 см2/с, толщина диффузионного слоя δd = 0,075 см. Сопоставить полученную величину с экспериментальным значением I = 52 мкА.
Решение. 1) В паре Сu-Zn медь является катодом, а цинк – анодом. Коррозионный ток локального элемента контролируется подводом кислорода к катоду.
Предельная катодная плотность тока равна: 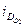 = nFD (
= nFD ( 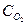 )o (
)o ( 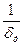 +
+ 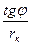 ).
).
2) Катодный ток Iк = iк Sк = i 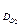 ·Sк = i
·Sк = i 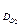 .πr
.πr 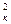 = nFDC
= nFDC 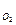 .πrк(
.πrк( 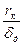 + tgφ)=
+ tgφ)=
= 4 . 9600 . 2,25.10-7 .1,95 .10-5 .3,14 . 0,803 ( 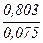 +1,273) = 5,1.10-5 A= 51 мкА
+1,273) = 5,1.10-5 A= 51 мкА
3) Сравним полученное расчетное значение с экспериментальным: 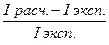 . 100 =
. 100 = 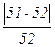 .100 ≈ 2 %.
.100 ≈ 2 %.
Расчетное значение локального тока пары практически совпадает с измеренной величиной.
Дата добавления: 2017-02-13; просмотров: 3533;











