Органо- и тканеспецифичность в распределении токсинов
Компартменты. Тело человека состоит в основном из воды, которая распределяется среди нескольких компартментов. Объем крови у взрослого человека составляет около 3-х литров. Объем внеклеточной жидкости, омывающей внутренние органы, достигает 15 литров. Включая количество воды внутри клеток, общий объем жидкости составляет приблизительно 42 литра. Лекарства и токсичные соединения по-разному распределяются среди этих компартментов, знания о которых могут быть важны для понимания последствий экспозиции. Предположим, что в кровь поступает 1г. соединения. Если оно остается в крови полностью (например, как антикоагулянт гепарин), то его концентрация будет составлять приблизительно 333 мг/литр. Напротив, если вещества распространяются во внеклеточной жидкости (например, альбумин или ионы хлора), то их концентрация в крови может быть всего 67 мг/литр. Если же вещество распределяется между вне- и внутриклеточной жидкостью (как этанол), то его концентрация в крови будет составлять около 24 мг/литр. Заметим, что объем распределения (Vd) находится в обратной зависимости от концентрации крови. Чем более свободно внутривенная доза соединения распространяется по телу, тем ниже его остаточная концентрация в крови. Параметр Vd может быть рассчитан как отношение вводимой дозы к концентрации в крови. Vd зависит от химических свойств соединения, является константой для данного вида и может быть определен спериментально. Подсчет Vd может быть полезен для определения нагрузки на организм, особенно для соединений, которые выводятся медленно. Эта информация может быть необходимой при проведении антидот терапии. Для некоторых соединений подсчитанные величины Vd являются очень большими, много больше, чем суммарный объем жидкости организма (т.е. 1000 литров). Такие величины кажутся противоестественными. Обычно такие соединения локализуются не в крови, а в других компартментах организма. Например, йод концентрируется в щитовидной железе. ТХДД - в жире, стронций – в костях. В жировой ткани обычно откладываются гидрофобные соединения, что препятствует их биотрансформации до более водорастворимых производных. Связывание с белками. Некоторые соединения в крови могут изолироваться путем связывания с белками. Альбумин, высокая концентрация которого обнаруживается в крови, имеет сайты связывания для гидрофобных соединений и способствует повышению растворимости соединений, которые иначе откладываются на стенках кровеносных сосудов или в тканях. Такое связывание может быть основным путем усиления экскреции. Хорошим примером является транспорт производных билирубина из поврежденных эритроцитов в печень. Трансферрин связывает железо, регулирует его доставку в клетки и предотвращает взаимодействие с восстанавливающими соединениями и кислородом, который генерирует токсичные высоко реакционноспособные производные. Стероидные гормоны связываются с определенными глобулинами, а витамин А и тиреоидные гормоны – с белком трансферитин. Будучи частью макромолекулярного комплекса, витамины и гормоны не фильтруются в почках, таким образом, предотвращается их потеря в результате фильтрации. В идеале скорость фильтрации соединения в почках, а, следовательно, время полувыведения, должно быть обратно пропорционально количеству соединения, связанного с белком в любой момент времени. Предположим, что соединение полностью не связано с белком и его время полувыведения составляет 3 часа. Если соединение свободно на 10% и на 90% связано в комплексе, слишком большом, чтобы фильтроваться, его ожидаемое время полувыведения увеличивается до 30 часов. В качестве примера можно привести 2,4-D(дихлорфеноксиуксусную кислоту). У камбалы это соединение является свободным на 30%, а время полувыведения составляет 5 часов, тогда как у крыс и собак свободно 10% и 3%, а соответствующее время полувыведения увеличивается до 14 и 87 часов. Белковое связывание в крови также ограничивает принятие органических ионов (типа 2,4-D) специальными транспортными системами в клетках проксимальных канальцев почек и их экспорт внутрь нефронов. Это может снизить скорость элиминирования даже больше, чем снижение скорости фильтрации. Изоляция соединений при помощи белков крови может ограничить их действие на клетки, поскольку свободная концентрация может быть значительно ниже, чем общая. Клетки часто разрабатывают специальные компенсаторные пути для поглощения некоторых питательных веществ. У индивидов, получавших большую дозу соединения, которое замещает связанное вещество, наблюдались токсические реакции. Например, когда антибиотики только начинали использовать, обнаружилось, что сульфониламиды замещают билирубин из альбумина плазмы. Когда большие дозы сульфониламидов назначали младенцам, наблюдалось ухудшение развития гематоэнцефалического барьера, а высвобождающийся билирубин вызывал повреждения мозга. Тетрациклин, не замещающий билирубин, может быть использован как альтернативный препарат. Разграничение слабых кислот/оснований. Многие лекарства и токсичные соединения являются слабыми кислотами или основаниями, что может сильно влиять на их распределение среди клеточных мембран. Следующее обсуждение предлагает упрощенный подход, без учета реакций биотрансформации и транспортных механизмов. Обычно обладающие зарядом ксенобиотики не диффундируют сквозь мембраны, в отличие от незаряженных. Поскольку рН сильно влияет на степень ионизации слабых кислот и оснований, этот фактор является критическим при определении, каким образом будут распределяться такие соединения. Предположим, была поглощена бензойная кислота (рКа≈5). В желудке (рН ≈2) она почти полностью будет находиться в незаряженной (кислотной) форме, способной пройти сквозь мембраны клеток желудка и достичь кровяного русла. Напротив, слабое основание анилин (рКа≈5) в желудке находится в заряженной форме, и не может пройти через мембраны. По аналогии, если есть подозрение, что человека отравили стрихнином, то медикам-экспертам следует в первую очередь проверить содержимое желудка. Cтепень ионизации при данном рН можно подсчитать, используя отношение Хендерсона-Хассельбелча (Henderson-Hasselbalch). Если слабая кислота (А) теряет протон, давая основание (В), то соотношение между этими формами и рН может быть выражено как рН - рКа = log[B]/[A]. Это соотношение можно использовать при подсчете относительной концентрации соединения в компартменте при разных рН. На примере анилина в желудке можно вычислить, что отношение незаряженной (основной) формы к заряженной (кислотной) составляет приблизительно 1/1000. В крови (рН ≈7), напротив, это соотношение 1/0,01. Количество незаряженной формы принято за 1 для удобства, поскольку она находится в равновесии между мембранами кровяного русла и желудка. Для подсчета относительной концентрации в крови и желудке в состоянии равновесия можно сравнить суммы форм в каждом компартменте в относительных единицах: в желудке = 1 + 1000 = 1001; в крови = 1 + 0.01 = 1.01. Таким образом, концентрация вещества в желудке ≈ в 1000 раз больше, чем в крови. Это очень грубое приближение, но оно дает представление, что вещество накапливается в том компартменте, где оно наиболее заряжено. Органы экскреции Кишечник (тонкая и ободочная кишка). Нижние отделы желудочно-кишечного тракта могут оказывать значительное влияние на биотрансформацию и судьбу ксенобиотика в организме. Критическим фактором здесь оказывается состояние кишечной микрофлоры. Популяция бактерий незначительна в желудке и проксимальных отделах кишечника и достаточно велика в дистальных отделах. Исследования позволили идентифицировать несколько сотен видов бактерий, но вероятно это только меньшая часть. Большинство из них являются облигатными анаэробами, особенно те, которые обитают в ободочной кишке. Полагают, что токсический ответ обусловлен генетическим полиморфизмом микрофлоры. Межиндивидуальные различия в состоянии микрофлоры предположительно обусловлены различиями в диете и окружении. Члены одной семьи обычно имеют сходный состав микрофлоры. Микрофлора нижних отделов желудочно-кишечного тракта участвует в реакциях биотрансформации, обратных к тем, которые протекают в печени и других аэробных участках. Важным примером является деконъюгация, удаление сульфата и глюкуроновой кислоты и деградация глутатиона. Результатом этих реакций является внепеченочная циркуляция отдельных соединений, например билирубина. После того как глюкуроновая кислота (присоединенная в печени) отделяется в кишечнике, она всасывается в кровь и вновь захватывается печенью и экскретируется с желчью, которая вбрасывается в кишечник. Другим примером является активация ксенобиотиков деконъюгацией. Циказин, соединение растительного происхождения, конъюгат с глюкозой, в некоторых странах присутствует в рационе питания. При удалении глюкозы остается производное диметилгидразина, нестабильное соединение, генерирующее метильные радикалы. Диметилгидразин, который вызывает рак ободочной кишки у крыс, часто метаболизируется аэробно с образованием сходных продуктов. CH3-N=N-CH2-O-глюкоза → СH3-N=N-CH2OH → [CH3-N=N]+ ↓ ↓ O O Другим примером обратной реакции в микроокружении нижних отделов кишечникаявляется реакция восстановления, например превращение диазо- соединений в амины, которое нашло практическое применение. В 1938 г. за разработку пронтозила, предшественника сульфониламидного антибиотика, была присуждена Нобелевская премия. При оральном приеме пронтозил восстанавливается в кишечнике до триаминобензена, что ведет к выработке сульфаниламидной активности. Другой пример – инкапсулированный инсулин (обычно инсулин инактивируется при оральном приеме). Было предложено создать полимерную форму типа R-C6H4-N=N-C6H4-R. При оральном приеме таких таблеток, инсулин будет высвобождаться в кишечнике, где он может взаимодействовать со слизью кишечника и поступать в кровяное русло. К отрицательным примерам относятся ароматические амины, которые используются как пищевые красители. Показано, что их прием с пищей вызывал рак мочевого пузыря у животных. Исследования показали, что сама микрофлора может являться источником ксенобиотиков, вызывающих рак ободочной кишки. В работах исследовался класс соединений, называемых фекалинами. Это соединение обладало сильным мутагенным и канцерогенным эффектом в бактериальных тестах. Такие наблюдения приводят к предположению о возможности эндогенного происхождения некоторых форм рака ободочной кишки. Мочевой пузырь. Основной причиной рака мочевого пузыря при определенных видах деятельности (например, производство красителей) являются ароматические амины. То, что существует корреляция между степенью экспозиции ароматическими аминами и раком мочевого пузыря, было замечено еще в 1895 г. В 1938 г. для исследования этого явления начали использовать собак. В 1953 г. эпидемиологические исследования показали, что среди 4622 рабочих, занятых на производстве красителей, зарегистрировано более 300 случаев рака.мочевого пузыря, умерло от этой болезни 127 человек. Метаболизм ароматических аминов, приводящий к раку мочевого пузыря, достаточно хорошо описан. Вначале амины N-гидроксилируются, рослее чего конъюгируют с глюкуроновой кислотой в печени, а затем в результате циркуляции накапливаются в моче. Моча человека имеет рН=5, а в этих условиях глюкурониды нестабильны и гидролизуются (конъюгаты могут также распадаться благодаря активности фермента глюкуронидазы в моче). Образовавшиеся N-гидроксиламины могут захватываться эпителиальными клетками мочевого пузыря и О-ацетилироваться или сульфатироваться, причем оба конъюгата нестабильны и распадаются с образованием высоко реакционноспособного арилнитрониум иона, способного атаковать макромолекулы клетки. В 1970-х годах предметом постоянных обсуждений служил сахарин натрия. Этот искусственный подсластитель вызывал рак мочевого пузыря у самцов крыс, но не у мышей, хомячков или обезьян. Соединение не метаболизировалось, не взаимодействовало с ДНК, не являлось мутагеном, однако в больших дозах избыточную пролиферацию (умеренную гиперплазию) эпителия мочевого пузыря, что, очевидно, является стимулом для образования опухоли. На основе этих данных сахарин был запрещен к употреблению, однако под действием общественного протеста Конгресс отклонил запрет. Последующие исследования не подтвердили, что избыток потребления сахарина вызывает рак. Недавно обнаружено, что большие дозы сахарина приводят к формированию кристаллов силиката вокруг α2-микроглобулина в мочевом пузыре самцов крыс. Кристаллы не формируются у тех видов животных, у которых уровень этого белка невысок. Кристаллы действуют как абразив, повреждая клетки эпителия, способствуя усилению пролиферации.Печень
Печень, как основной метаболический орган тела, играет центральную роль в токсикологии. Это крупнейшая железа, составляющая приблизительно 2% массы тела взрослого человека, и выполняющая множество физиологических функций. Это и расщепление углеводов и регуляция уровня глюкозы в крови, запас витамина А, секреция альбумина и широкого спектра других экзокринных и эндокринных продуктов. Печень получает значительную фракцию (25%) сердечного выброса. 5% от этого количества поступает напрямую из артериального русла, остальные 20% - из портальной вены. Венозная кровь обогащена питательными веществами, которые всасываются из пищеварительного тракта. Они поступают в печень для обработки, прежде чем они поступят в основной круг кровообращения. Таким образом, токсические соединения, принимаемые орально, не попадают в кровяное русло, поскольку они удаляются на «первом перевале метаболизма». По этой причине у рызунов печень является главной мишенью для токсичных соединений. У более крупных животных и человека в том числе, первичный метаболизм в печени не настолько важен, поскольку мишенью могут являться и другие периферические ткани. Печень состоит из долек, так чтобы экспозиция гепатоцитов плазмой стала максимальной. Каждая из 106 долек имеет диаметр 1 мм и содержит в центре капилляр, отходящий от центральной вены, для сбора крови, после того, как она перколирует между гепатоцитами. Гепатоциты располагаются в виде связок, разделяемых синусоидальными капиллярами в которых эндотелиальные клетки формируют прерывистый барьер (в отличие от большинства других органов, где эти клетки плотно соединены). С одной стороны каждый гепатоцит омывается плазмой крови, с другой стороны имеется микровиллярная мембрана, которая формирует границу. Каналикулы (малые каналы) несут желчь, содержащую плохо растворимые продукты, назад к краю дольки, т.е. туда, где желчные канальцы локализуются вблизи ответвлений печеночной артерии и портальной вены. Среди других типов клеток, обнаруживаемых в печени, наиболее подходящими для токсикологии являются фибробласты. Клетки этого типа являются составляющими соединительной ткани, секретируют коллаген и эластин (структурные фибриллярные белки), которые поддерживают должное расположение клеток. В печени они обычно немногочисленны, однако при определенных болезнях некоторых органов, они появляются в пространстве, обычно занятом другими типами клеток. Такое патологическое состояние принято называть фиброзом. Гипоксия. Патологические эффекты кислородного голодания не ограничиваются печенью, а имеют место в большинстве тканей. Гепатоциты чувствительны к гипоксии. Среди многих случаев гипоксии, наиболее распространенным является воздействие монооксидом углерода (подобным же образом действует сульфид водорода). Этот газ хорошо связывается с гемоглобином, вытесняя кислород. В результате ткани испытывают кислородное голодание, митохондриальное дыхание замедляется или останавливается, запас АТФ в клетках истощается. Это приводит к тяжелым последствиям. Клетки способны генерировать некоторое количество энергии анаэробным гликолизом, при этом образуется молочная кислота. Тем временем ионные насосы, необходимые для поддержания надлежащего ионного состояния, инактивируются, что приводит к разбуханию клетки, нарушению рН регуляции и остановке белкового синтеза. Уровень кальция в цитоплазме (в норме 0,1 µМ) достигает 1мМ, активируя ферменты деградации. Происходит утечка содержимого лизосом. Результатом длительного кислородного голодания является смерть клетки (некроз). Отметим, что критическим признаком патологической гипоксии является потеря надлежащего ионного состояния. Действие ряда токсинов, направленное на ионные каналы, может приводить к такому же результату. Цианиды. Основной макромолекулярной мишенью для цианидов является цитохром оксидаза, компонент митохондриальной цепи транспорта электронов. Ингибирование этого фермента приводит к остановке клеточного дыхания и синтеза АТФ, и в результате к гибели клетки. Летальность для организма имеет место при относительно низких дозах (LD50 для человека LD50 1мг/кг). Человек может подвергнуться воздействию различными способами, включая диету (высвобождение из цианогенных гликозидов, содержащихся в миндале). Цианид выделяли из фруктовых косточек, который являлся активным веществом в малоэффективном, но некогда популярном антираковом препарате – “Laetrile”. Эффект воздействия цианидов можно наблюдать и в дикой природе, например в нескоординированном поведении малиновки, после съедания определенных ягод. Организм человека способен детоксифицировать низкую дозу цианидов путем превращения в тиоцианат, который легко экскретируется. Это происходит с помощью фермента роданазы, который переносит серу тиосульфата на цианид. Хотя эндогенный запас этого соединения быстро истощается, он может быть восполнен инъекцией тиосульфата в кровь. Такие инъекции действительно применяются при отравлениях цианидами. Однако, митохондрии выдерживают блокаду лишь в течение очень короткого времени, а затем клетки погибают. Таким образом, необходим способ удаления цианида из цитохром оксидазы, до того как родазана закончит его превращение в тиоцианат. Этого можно достичь путем инъекции жертве нитрита натрия одновременно с тиосульфатом натрия. Нитрит реагирует с оксигемоглобином (содержащим гем с окисленным атомом железа) превращая его в метгемоглобин (атом железа в восстановленном состоянии). Метгемоглобин связывается с цианидом и удаляет его из цитохром оксидазы. Более чем 40% гемоглобина может быть превращено в метгемоглобин без последствий (хотя для обычной терапии это 25%). Известны случаи, когда простая инъекция нитрита помогала вернуть сознание жертве. Однако, поскольку метгемоглобин способен быстро превратиться обратно в оксигемоглобин и вновь связаться с цитохром оксидазой, инъекции тиосульфата имеют большое значение для более интенсивного удаления цианида. Сообщалось, что эта комбинация увеличивает LD50 для овецв 16 раз. Фактором, ограничивающим лечение, является эффективность удаления цианида из центральной нервной системы. Холестазия. Желчь служит основным источником выведения плохо растворимых продуктов отхода, включая продукты реакции II- фазы метаболизма. Желчь содержит соли и глюкозу приблизительно в той же концентрации, что и плазма, а концентрация производных холестерола с функциональными группами карбоксильных кислот является в 100 раз выше, чем в крови. В желчи они оказывают эффекты подобные детергентам, и в кишечнике (где желчные протоки пустые) они эмульгируют жиры и способствуют усвоению гидрофобных витаминов. Время жизни эритроцитов составляет приблизительно 120 дней, после чего их содержимое деградирует. Это приводит к образованию значительного количества плохо растворимого гемина (из гемоглобина), который удаляется с желчью. Гемин окисляется с образованием билирубина, который связывается с альбумином и в таком виде переносится кровью и откладывается в печени. В гепатоцитах происходит конъюгация билирубина с глюкуроновой кислотой и секреция в желчные каналы. Конъюгаты деградируют с помощью кишечной микрофлоры и в основном (80-90%) экскретируются. Остаток вновь всасывается в кровяное русло через портальную вену (некоторые ксенобиотики также подвергаются такой энтеропеченочной циркуляции). Застой желчного потока приводит к ухудшению распределения билирубина, который начинает накапливаться и откладываться в селезенке, костном мозге, почках и коже. Последнее приводит к появлению желто-оранжевого цвета кожи, указывающего на желтуху. Причиной желтухи может стать усиление выработки билирубина (как при гемолитической анемии) либо слабая конъюгация с глюкуроновой кислотой (желтуха новорожденных). Токсичные соединения часто вызывают холестазию, нарушая секреторный процесс в каналикулярной мембране и выведение конъюгатов из гепатоцитов в желчь. Секреция желчных солей также нарушается, что приводит к внутриклеточному накоплению этих детергентоподобных соединений и в дальнейшем к повреждению клеточных мембран. Как сообщалось, в число соединений, вызывающих холестазию, входят некоторые анаболики и стероиды-контрацептивы. Накопление триглицеридов в печени само по себе не опасно и этот процесс легко обратим. Это неспецифический симптом неспособности гепатоцитов секретировать липопротеины такие как VLDL (липопротеины очень низкой плотности) в силу различных причин. Например, ингибирование (специфическое или вторичное) белкового синтеза может вызвать дефицит белковых компонентов этого комплекса, предотвращая секрецию липидов. Аналогично, холин-дефицитная диета может привести к дефициту фосфолипидных компонентов комплекса. Ряд соединений (оротовая кислота) ослабляют секрецию, которая очевидно является очень чувствительной к токсичному инсульту. Основной причиной ожирения печени является усиление всасывания или образования жирных кислот. Например, повышенное потребление этанола приводит к избытку ацетата и NADH благодаря действию алкогольдегидрогеназы и альдегиддегидрогеназы. CH3CH2OH --> CH3CHO --> CH3COOH --> АцетилКоА (ЦТК) НAД+ + H+ --> НAДH При поступлении в цикл трикарбоновых кислот ацетат увеличивает образование жирных кислот, а НAДH замедляет превращение жирных кислот в ацетат. Заметим, что образование карбоксикислот может также иметь место в этой цепочке. Микробы потенциально являются полезными в распределении жира, катализируя первоначальное гидроксилирование алканов, на которые затем действуют алкоголь- и альдегиддегидрогеназы. Кровь освобождается от этилового спирта в основном (75%) при помощи его метаболизма в печени. У индивидов с высокой концентрацией крови скорость метаболизма универсальна и составляет порядка 10гр/час, независимо от концентрации алкоголя. Метаболизм других соединений может происходить двумя способами. С одной стороны этанол индуцирует активность цитохромов Р450. С другой стороны – этанол является предпочтительным субстратом для некоторых изоферментов, особенно в высоких концентрациях, приводя к снижению скорости метаболизма некоторых фармацевтических препаратов и вызывая эффект передозировки. Например, исследования показали, что при потреблении пережаренного мяса в крови у добровольцев регистрировался диметилнитрозоамин только лишь при употреблении мяса совместно с алкоголем. Иначе нитрозоамины удаляются в печени за одну стадию метаболизма. Цирроз. Долговременное действие этанола на печень может привести к хроническому состоянию, когда свойственные печени функции угнетаются. В основе этой болезни лежит ослабление гепатоцитов, вероятно из-за накопления ацетальдегида, который является продуктом действия алкогольдегидрогеназы. Это высоко реакционноспособное соединение, которое может формировать основание Шиффа с аминогруппами белков и возможно с ДНК, что приводит к некрозу. Недавно было показано, что ацетальдегид в присутствии избытка этанола ускоряет формирование как долгоживущих ацетатов c основаниями ДНК, что, возможно, объясняет корреляцию между потреблением алкоголя и случаями рака. В ответ на это стимулируется регенерация и деление выживших гепатоцитов для восстановления их количества. Однако когда эти процессы происходят хронически, тонкая архитектура долек теряется. Фибробласты являются относительно устойчивыми к токсическим эффектам алкоголя и могут замещать гепатоциты, нарушая поток крови и желчи, образуя полосу рубцовой ткани (расположение коллагена). Печеночные клетки регенерируют в узелки, которые не столь хорошо перфузируются. Таким образом, они не могут эффективно удалять токсичный материал и выполнять нормальные регуляторные и гомеостатические функции. Цирроз характеризуется некрозом и фиброзом с узелковой регенерацией. Когда повреждения накапливаются в достаточном количестве, это состояние приводит к фатальному исходу. При низком уровне всасывания этанола, образование ацетальдегида не является серьезной проблемой. Однако, у некоторых индивидов, особенно в определенных этнических группах, активность ацетальдегид дегидрогеназы очень низка, так что даже всасывание небольшой дозы алкоголя приводит к болезненному состоянию. Этот синдром часто наблюдался в индустриальных районах. Исследования показали, что некоторые рабочие подвергались воздействию соединения, которое является ингибитором алкоголь дегидрогеназы. Это антиоксидант («Disulfirame» или “Antabuse”), который ранее использовался для лечения алкоголиков, чтобы предотвратить всасывание этанола и, следовательно, вредные последствия его действия (т.е. цирроз). Пациенты должны находиться под наблюдением, поскольку прием алкоголя во время лечения весьма опасен. Канцерогенез печени. В отсутствие убедительных эпидемиологических доказательств, химическое соединение может быть отнесено к классу канцерогенов, если оно вызывало рак у подопытных животных. Не все соединения, дающие положительную реакцию в бактериальных тестах на мутагенность, оказываются канцерогенами животных. Проведение стандартных тестов на животных требует больших затрат ($0.5 млн. и более) и занимает около 2-х лет. Чтобы снизить затраты и ускорить получение результатов, разрабатывают тесты по инициации/ промоции. В таких тестах обычно использовали кожу мышей, но полезно также использование печени крыс, поскольку этот орган является основной мишенью для химических соединений. Когда тесты на животных только начинали применяться, в дозо-зависимых экспериментах на крысах, получавших единственную дозу канцерогена, например диэтилнитрозоамина, было продемонстрировано, что число случаев рака является нелинейной функцией от дозы канцерогена. Обычно число случаев рака пропорционально дозе в степени n, где n=3 и более. Оказалось, что вероятность развития рака выше, если дозы канцерогена достаточно чтобы вызвать некроз органа-мишени. Таким образом, повреждение клеток и клеточная смерть дает некоторое преимущество редким раковым клеткам и способствует развитию опухоли. Предполагалось, что некроз стимулирует процессы регенерации клеток, в которых выжившие клетки размножаются, чтобы заполнить образовавшиеся пробелы. В печени, где в норме клетки не делятся, этот процесс позволяет нестабильным клеткам, с мутациями в ДНК, увеличивать степень отклонения от нормы, приобретать черты агрессивного роста, и окончательно формировать опухоль. Эти наблюдения привели к разработке модели, основанной на крысиных гепатоцитах, для тестирования соединений, способствующих инициации и промоции опухолей. Крысы подвергались частичной гепатоэктомии, при которой половина или более печени удалялась. Это стимулировало синтез ДНК в оставшихся гепатоцитах. Спустя 12 часов крысы получали низкую дозу канцерогена, которая сама по себе не приводила к развитию опухоли. Этот шаг являлся «инициацией». Поскольку синтез ДНК продолжался, полученные повреждения с большей вероятностью приводили к появлению мутаций, чем в неделящихся клетках. В отсутствии частичной гепатоэктомии, клетки способны успешно репарировать большее количество повреждений ДНК, и количество возникающих опухолей будет значительно ниже. Как только повреждение ДНК зафиксировано (т.е. индуцированы мутации), следующим шагом является стимулирование (промотирование) опухолей печени. Подопытные крысы получали тетрахлорид углерода (CCl4) с питьевой водой. Это соединение подвергается восстановлению в печени при участии цитохрома Р450, с образованием хлорид-иона (безвредного) и трихлорметил радикала (.CCl3). Последний очень токсичен, атакует ненасыщенные липиды, удаляя радикал .Н. Липидные радикалы связываются с О2, приводя к формированию пероксидов липидов, которые в свою очередь формируют радикалы в цепной реакции. В тех клетках, где защита недостаточна, это приводит к смерти. Крысы продолжают пить воду с CCl4 в течение 10-12 недель, что обеспечивает условия, стимулирующие клеточное деление и восполнение потерь от некроза. Использование опухолевых промоторов, таких как CCl4, иллюстрирует «устойчивость гепатоцитарной модели». Используемый промотор для проявления токсичных свойств нуждается в метаболизме цитохромом Р450. Модель имеет ряд преимуществ, характерных для инициированных гепатоцитов. По неясным причинам в инициированных гепатоцитах экспрессия цитохромов Р450 значительно снижается, а экспрессия ферментов 2-й фазы увеличивается. В таких клетках не происходит эффективный, с образованием радикалов, метаболизм CCl4, в отличие от неинициированных клеток, а сами клетки будут иметь селективное преимущество. Они будут расти лучше, чем окружающие клетки, которые постепенно повреждаются под действием активности цитохромов Р450. Не все промоторы действуют таким образом. Вместо добавления CCl4 в воду, стимулировать опухоли можно при помощи холин- или метионин-дефицитной диеты. Это затрудняет метилирование ДНК и, следовательно, изменяет экспрессию генов, возможно благоприятным образом для генов, ответственных за стимуляцию роста. ТХДД также является соединением, стимулирующим канцерогенез в печени крыс. Он не метаболизируется, но изменяет экспрессию генов, опосредованную Ah-рецептором. Механизм его действия малопонятен. Конечным результатом схемы инициации/промоции является рак печени, который можно наблюдать у подопытных животных через несколько месяцев. Можно наблюдать за постепенным развитием опухолей. Спустя несколько недель после стимулирования, в дольках печени крыс обнаруживаются очаги в количестве 1000 и более на печень. Центрами очагов являются группы клеток, предположительно одного происхождения, которые отличаются от нормальных клеток обычно по размеру, но могут отличаться и по другим критериям. Например, в этих клетках может быть значительно увеличена или снижена активность определенных ферментов. С увеличением времени обработки канцерогеном размер очагов увеличивается, однако лишь небольшой процент (около 1%) со временем развивается в опухоль. Клетки очагов, особенно на поздних стадиях развития, обнаруживают черты типичных раковых клеток, таких как абнормальное число хромосом, абберантные или поврежденные хромосомы или митозы. Иногда внутри большого очага можно обнаружить малый участок, причем клетки малого очага более абнормальны, чем окружение. Окончательно некоторые очаги перерастают в автономные узелки, продолжая рост уже без дополнительных внешних стимулов, приобретая злокачественный характер. Модель с использованием печени крыс может быть использована для тестирования химических соединений по их действию в качестве инициатора или промотора рака. Потенциальные инициаторы могут быть также проверены в бактериальных тестах на генотоксичность, однако эти тесты менее определенны. Предположим, кто-либо хочет проверить является ли соединение Х промотором рака в этой системе. Крыс можно обработать низкой дозой известного инициатора рака, например диэтилнитрозоамина (после соответствующей гепатоэктомии), а затем добавить соединение Х в питьевую воду. Спустя месяц подсчитывается число очагов или опухолей в печени (заметим, что таким образом было показано, что эстроген стимулирует опухолеобразование в печени крыс). Во время появления первых противозачаточных таблеток, у некоторых женщин наблюдалось развитие доброкачественной аденомы печени, которое прекращалось после отмены таблеток. В таких тестах важно подобрать подходящий контроль. Обычно крысы обрабатываются либо известным инициатором, либо известным промотором или же соединением Х высокой, но толерантной дозы (что обычно определяется заранее) вместе или без известного инициатора или промотора, в зависимости от целей теста. В целом полагают, что доза инициатора влияет на число очагов, а длительность применения промотора определяет, насколько сильно эти очаги будут развиваться. Применение промотора позволяет обнаружить очаги, а изучение дозо-зависимости позволяет достичь линейности. Модель устойчива к развитию некрозов, которые обычно имеют место при высокой дозе инициатора. Ограничением применения моделей на основе печени крыс и кожи мышей является то, что соединения могут обнаруживать тканеспецифичность действия. Так бензо[а]пирен и эфиры форбола могут использоваться в модели только с мышиным эпителием. Диэтилнитрозоамин и тетрахлорид углерода не метаболизируются клетками эпидермиса мышей, в отличие от печени крыс. Понимание тканеспецифичности помогает глубже понять механизм действия соединений и область их применения. В качестве примера можно привести развитие карциномы слизистой оболочки носа крыс под действием фенацетина (производное ацетаминофена, образуется in vivo). Фенацетин метаболизируется клетками эпителия с образованием токсичного иминохинона. Высокая доза фенацетина приводит к некрозу клеток и усилению деления выживших клеток, что предположительно является причиной возникновения рака. Проблема экстраполяции результатов, полученных на одном виде животных на другой вид (или на человека), далеко не тривиальна. Например, более 25 лет назад было замечено, что некоторые соединения способствуют увеличению внутриклеточного содержания пероксисом в печени крыс с 2 до 25% объема. Эти органеллы связаны с мембраной клетки и содержат окислительные ферменты, импортируемые из цитоплазмы. В отличие от митохондрий они не содержат ДНК, РНК или рибосом и не реплицируются автономно. Пероксисомы включают ферменты катализирующие окисление липидов, Р450, которые катализируют окисление алканов, определенные оксидазы (Д-амино кислот), образующие пероксид. Некоторые соединения (клофибрат) индуцируют пролиферацию пероксисом в печени крыс, и их применение в количестве 1 грамма в день снижает уровень липидов в крови. Другой класс соединений включает пластмассы типа ди-(2-этилгексилфталата),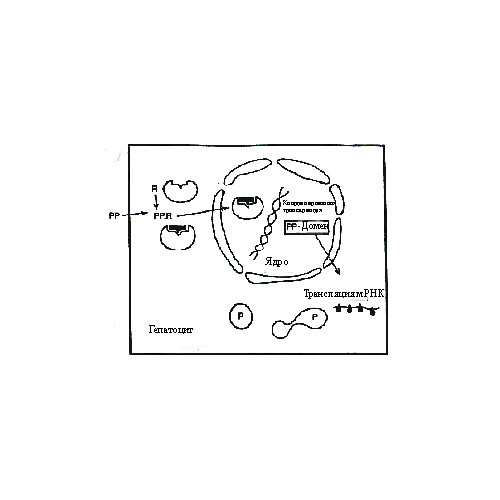 Рис. 10. Предположительный механизм индукции пролиферации пероксисом ксенобиотиками. широко распространенного в окружающей среде. Содержание фталата в пластмассе может доходить до 40%, и это соединение легко вымывается в воде. Соединение дает отрицательный ответ в тесте на генотоксичность, однако действует как промотор рака в печени крыс. Согласно одной из гипотез, фтален стимулирует пролиферацию пероксисом, что приводит к увеличению уровня пероксида. В подтверждение этой теории показано, что назначение антиоксидантов может ингибировать развитие рака под действием фталена. Несмотря на стимулирование пероксисомной пролиферации у крыс, эти соединения неэффективны в отношении других видов (собак, морских свинок, резус-макак, человека). Поэтому результаты тестов, основанных на использовании крысиной печени неприменимы для человека. Недавние исследования показали, что эффект пероксисомной пролиферации опосредован рецептором, который действует в ядрах клеток, стимулируя пролиферацию органелл. Рис. 10 иллюстрирует механизм действия, который аналогичен действию Ah-рецептора или семейства стероидных рецепторов, стимулирующих транскрипцию генов. Соединение, стимулирующее пролиферацию пероксисом (пероксисомный пролифератор, РР) попадая в клетку путем диффузии через плазменную мембрану, связывается со специфическим белком-рецептором (R), который в свою очередь обладает высокой аффинностью к специфичным сайтам ДНК. Это означает, что пероксисомный пролифератор запускает т
Рис. 10. Предположительный механизм индукции пролиферации пероксисом ксенобиотиками. широко распространенного в окружающей среде. Содержание фталата в пластмассе может доходить до 40%, и это соединение легко вымывается в воде. Соединение дает отрицательный ответ в тесте на генотоксичность, однако действует как промотор рака в печени крыс. Согласно одной из гипотез, фтален стимулирует пролиферацию пероксисом, что приводит к увеличению уровня пероксида. В подтверждение этой теории показано, что назначение антиоксидантов может ингибировать развитие рака под действием фталена. Несмотря на стимулирование пероксисомной пролиферации у крыс, эти соединения неэффективны в отношении других видов (собак, морских свинок, резус-макак, человека). Поэтому результаты тестов, основанных на использовании крысиной печени неприменимы для человека. Недавние исследования показали, что эффект пероксисомной пролиферации опосредован рецептором, который действует в ядрах клеток, стимулируя пролиферацию органелл. Рис. 10 иллюстрирует механизм действия, который аналогичен действию Ah-рецептора или семейства стероидных рецепторов, стимулирующих транскрипцию генов. Соединение, стимулирующее пролиферацию пероксисом (пероксисомный пролифератор, РР) попадая в клетку путем диффузии через плазменную мембрану, связывается со специфическим белком-рецептором (R), который в свою очередь обладает высокой аффинностью к специфичным сайтам ДНК. Это означает, что пероксисомный пролифератор запускает т
Дата добавления: 2019-09-30; просмотров: 849;











