N-ацетилтрансферазы
N-ацетилирование – основной путь биотрансформации для ароматических аминов или ксенобиотиков, в том числе и лекарств, содержащих гидразогруппу (R-NH-NH2), которые превращаются в ароматические амиды (R-NH-COCH3) или гидразиды (R-NH-NH-COCH3), соответственно. Первичные алифатические амины редко подвергаются N-ацетилированию за исключением цистеиновых конъюгатов, образующихся из глютатионовых, которые, в свою очередь, путем N-ацетилирования в почках превращаются в меркаптуровую кислоту. Многие N-ацетилированные метаболиты менее, чем исходные соединения, растворимы в воде. Однако в отдельных случаях, например, для изониазида, N-ацетилирование облегчает экскрецию метаболитов с мочой. Реакция N-ацетилирования катализируется ферментами, называемыми N-ацетилтрансферазы (NAT) и требует присутствия ацетил-кофермента А (Ац-КоА) в качестве кофактора. Реакция протекает в два последовательных шага. Первым этапом ацетильная группа Ац-КоА переносится к цистеиновому остатку внутри активного центра фермента с высвобождением кофермента А: E-SH + КoA-COCH3 →E-S-COCH3 + КoA-SH Вторым шагом ацетильная группа Ац-КоА переносится с ацетилированного фермента на аминогруппу субстрата. Для сильноосновных аминов скорость N-ацетилирования определяется первым шагом , тогда как для слабоосновных – вторым. В определенных случаях NAT могут катализировать реакцию О-ацетилирования. NAT – цитозольные ферменты, которые были найдены в печени и многих других тканях у большинства видов млекопитающих, за исключением лис и собак, неспособных к N-ацетилированию ксенобиотиков. У кроликов, мышей экспрессируется две формы NAT, обозначаемых NAT1 и NAT2. По последним данным у человека идентифицировано, кроме этих двух классов, еще 3 класса ферментов: арилалкин-N-ацетилтрансфераза (AANAT), L1-протеин-регулятор адгезии клеток (L1 CAM) и гомолог Saccharomyces cerevisiae N- ацетилтрансферазы у человека (ARD1). NAT1 и NAT2 являются близкими по первичной структуре (79-95% гомологии аминокислотной последовательности, в зависимости от вида). У всех белков в активном центре присутствует цистеин (Cys68). Оба белка кодируются генами, не содержащими интронов. Гены NAT хотя и расположены на одной хромосоме, но регулируются независимо друг от друга. NAT1 экспрессируется в большинстве тканей организма, тогда как NAT2, по-видимому, только в печени и кишечнике. Эти ферменты отличаются по субстратной специфичности, хотя и имеется перекрывание. Субстратами, предпочтительно N-ацетилируемыми человеческой NAT1, являются парааминосалициловая кислота, парааминобензойная кислота, сульфаметоксазол. Субстраты, преимущественно N-цетилируемые при участии NAT2, включают изониазид, гидралазин, сульфаметазин, дапсон. Некоторые ксенобиотики, например, 2-аминофлуорен одинаково хорошо метаболизируются обоими ферментами. Генетический полиморфизм N-ацетилирования показан у хомяков, мышей, кроликов. Вариации в NAT2-локусе отвечают за классический полиморфизм ацетилирования, подразделяющий индивидуумов на «быстрых», «средних» и «медленных» ацетиляторов. Определенные вариации NAT1-локуса приводят к усилению активностей N-, О- или N,О-ацетилирования по сравнению с диким типом. Серия клинических наблюдений, проведенных в 50-х годах, установила существование так называемых ««медленных»» ацетиляторов антитуберкулезного лекарства изониазида. Встречаемость этого фенотипа довольно высокая на Среднем Востоке (около 70% в Египте и Саудовской Аравии), средняя в Европе, на Кавказе, в Америке и Австралии (около 50%), низкая в азиатской популяции (менее 25% в Китае, Японии, Корее). В настоящее время варианты по статусу ацетилирования описаны и у человека и у животных. Фенотип медленного ацетилирования возникает в результате мутаций NAT2 гена, которые приводят либо к снижению активности фермента, либо к снижению его стабильности. Например, точковая мутация в 341 нуклеотиде приводит к аминокислотной замене Ile114 - Thr и снижает максимальную скорость N-ацетилирования (Vmax) без изменения Кm для связывания субстрата или стабильности фермента. Эта мутация часто встречается среди кавказской популяции, но редко среди азиатской. Внутри фенотипа медленного ацетилирования существуют значительные вариации в скорости ацетилирования ксенобиотиков, поскольку различные мутации оказывают различное действие на активность и/или стабильность NAT2. У «медленных» ацетиляторов значительным оказывается N-ацетилирование “NАT2-субстратов” при помощи NAT1. Генетический полиморфизм NAT2 оказывает токсикологическое и фармакологическое влияние на метаболизм лекарств, которые N-ацетилируются этим ферментом. Например, фармакологический эффект антигипотензивного лекарства гидралазина является более продолжительным у «медленных» ацетиляторов, тогда как медленные ацетиляторы предрасположены к различным лекарственным отравлениям. «Медленные» ацетиляторы, которые к тому же дефицитны по глюкозо-6-фосфатдегидрогеназе, особенно склонны к гемолизу под действием определенных сульфонамидов. «Быстрые» ацетиляторы предрасположены к миелотоксическим эффектам амонафидов, поскольку N-ацетилирование замедляет выведение этих антинеопластических лекарств.Сульфотрансферазы
Многие ксенобиотики, подвергающиеся О-глюкуронидации, подвергаются и сульфатной конъюгации. Сульфатные конъюгаты представляют собой хорошо водорастворимые эфиры серной кислоты. Реакция катализируется сульфотрансферазами, группой ферментов обнаруженных в печени, почках, кишечнике, легких, мозге. Кофактором реакции служит 3’-фосфоаденозин-5’-фосфосульфат (PAPS), который в организме синтезируется из АТФ и неорганического сульфата. Сульфатная конъюгация алифатических спиртов и фенолов протекает по следующей схеме: R-OH + фосфоаденозин-ОРО2 SO4 --> ROSO3- + фосфоаденозин-О-РО32- + Н+ Сульфатная конъюгация включает перенос SO3- от PAPS к ксенобиотикам. Субстраты для реакции не ограничиваются спиртами и фенолами, которые часто являются продуктами реакции 1-й фазы. К ксенобиотикам, не требующим предварительной активации ферментами 1-й фазы относятся первичные и вторичные спирты, желчные кислоты, катехолы, определенные ароматические амины, например, анилин и 2-аминонафтален, конъюгирующие с PAPS с образованием соответствующих сульфаматов. N-гидроксиариламины также являются субстратами для сульфотрансфераз. Во всех случаях реакция включает нуклеофильную атаку атомов кислорода или азота на атом серы в PAPS с расщеплением фосфосульфатной связи.Сульфатные конъюгаты ксенобиотиков экскретируются в основном с мочой. Метаболиты, экскретируемые с желчью могут быть гидролизованы арилсульфатазами, присутствующими в микрофлоре кишечника, что способствует энтеропеченочной циркуляции ксенобиотика. Сульфатазы присутствуют и в эндоплазматическом ретикулуме и в лизосомах, где преимущественно гидролизуют сульфаты эндогенных соединений. Некоторые сульфатные конъюгаты подвергаются дальнейшей биотрансформации. Например, андростен 3,17-диол-3,17--гидроксилируется с участием цитохрома Р450 2С12, специфичного длядисульфат далее 15 самок крыс фермента. Сульфатирование благоприятствует дейодированию тироксина и трийодтирозина и может определять скорость элиминирования тиреоидных гормонов. Относительно низкая концентрация PAPS в клетке (около 75мкМ, для сравнения – концентрация УДФ-глюкуроновой кислоты составляет около 350мкМ) ограничивает возможности сульфатирования ксенобиотиков. В целом этот путь биотрансформации представляется высокоспецифичным, но низкоемким. Ряд соединений одновременно являются субстратами и для сульфотрансфераз и для УДФ-глюкуронозилтрансфераз, при этом выбор пути метаболизма может зависеть от концентрации субстрата, доступности кофакторов и т.д. Например, относительное содержание продуктов метаболизма ацетаминофена зависит от дозы препарата: при низких дозах преобладают сульфатные конъюгаты, а с увеличением дозы происходит насыщение метаболического пути и, возможно, за счет ингибирования активности сульфотрансфераз, снижение относительного количества сульфатных конъюгатов по сравнению с глюкуроновыми. Обнаружены множественные формы сульфотрансфераз, которые являются членами одного суперсемейства. Суперсемейство подразделяется на ряд подсемейств: 1А, 1В, 1С, 1Е, 2А, 2В и 3А исходя из гомологии аминокислотной последовательности. Номенклатура индивидуальных форм ферментов не разработана окончательно, поэтому иногда сульфотрансферазы подразделяют на 5 классов исходя из субстратной специфичности: арилсульфотрансферазы - сульфатируют большое количество фенольных ксенобиотиков; алкогольсульфотрансферазы - метаболизируют первичные и вторичные спирты, включая неароматические гидроксистероиды; эстрогенсульфотрансфераза – ароматические гидрооксистероиды; тирозинсульфотрансфераза – тирозин метиловые эфиры, желчные кислоты. У человека в цитозоле печени обнаружено 3 вида сульфотрансфераз: два изофермента фенольной сульфотрансферазы и одна стероид/желчная сульфотрансфераза, называемая также дегидроэпиандростерон-сульфотрансфераза (DHEA-ST). Фенольные сульфотрансферазы отличаются по термостабильности – одна из форм является термостабильной, а вторая – термолабильной. Исследование роли сульфотранфераз в биоактивации 4-аминобифенила показало, что N-OH-аминобифенилсульфотрансферазная активность в печени и кишечнике коррелировала с активностью термостабильной ST, но не с активностями термолабильной ST или DHEA-ST. Используя арилсульфотрансферазную пробу мРНК (HAST1), была продемонстрирована заметная сульфотрансферазная экспрессия в толстом и тонком кишечнике, легком, желудке и печени человека. В целом, сульфатирование эффективно снижает фармакологическую и оксикологическую активность ксенобиотиков. Однако в некоторых случаях сульфатирование увеличивает токсичность чужеродных соединений, поскольку отдельные сульфатные конъюгаты химически нестабильны и деградируют, формируя сильные электрофильные соединения. Сульфоконъюгация является необходимым этапом активации многих проканцерогенов, таких как ацетиламинофлуорен, ариламины, эстрадиол и др. Многие N-гидроксиариламины и гидроксамовые кислоты обладали мутагенным эффектом в присутствии сульфотрансферазной активности. Для детектирования мутагенного эффекта важно, что сульфатирование имеет место внутри клеток-мишеней, поскольку сульфатные конъюгаты из-за своего заряда не могут проникнуть сквозь клеточные мембраны.Эпоксидгидролаза
Эти ферменты катализируют трансформацию многих реактивных и специфических эпоксидов в дигидродиолы, которые для многих соединений являются неактивными. Но в некоторых случаях, например, для ПАУ, образуются особо опасные эпоксид-дигидродиолы. Гидролазная реакция (рис. 9) трансформирует эпоксид в диол. Фермент катализирует нуклеофильную атаку водой или ОН- с противоположной стороны эпоксидного кольца.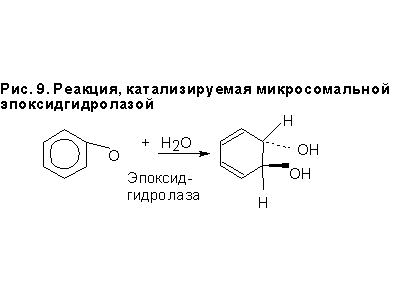 Рис. 9. Реакция, катализируемая микросомальной эпоксидгидролазой Образующиеся диолы имеют транс-конфигурацию. Фермента много в почках и печени. Извесно 5 форм эпоксидгидролазы: холестериновая, лейкотриеновая, гепоксилиновая, микросомальная и растворимая. Две последние участвуют в метаболизме ксенобиотиков. Микросомальная эпоксидгидролаза гидрирует монозамещенные, 1,1-дизамещенные и цис-1,2- дизамещенные эпоксиды и эпоксиды на циклических системах. Она инактивирует эпоксиды после ферментов 1-й фазы. Водорастворимая эпоксидгидролаза гидрирует широкий спектр эпоксидов, но не циклические системы.
Рис. 9. Реакция, катализируемая микросомальной эпоксидгидролазой Образующиеся диолы имеют транс-конфигурацию. Фермента много в почках и печени. Извесно 5 форм эпоксидгидролазы: холестериновая, лейкотриеновая, гепоксилиновая, микросомальная и растворимая. Две последние участвуют в метаболизме ксенобиотиков. Микросомальная эпоксидгидролаза гидрирует монозамещенные, 1,1-дизамещенные и цис-1,2- дизамещенные эпоксиды и эпоксиды на циклических системах. Она инактивирует эпоксиды после ферментов 1-й фазы. Водорастворимая эпоксидгидролаза гидрирует широкий спектр эпоксидов, но не циклические системы.
Дата добавления: 2019-09-30; просмотров: 1027;











