Глютатион-S-трансферазы (ГSТ)
Глютатион (ГSH) представляет собой трипептид, состоящий из глицина, цистеина и -карбоксильную группу. Вглутаминовой кислоты, которая связана с цистеином через результате нуклеофильной атаки глютатион тиолат аниона на электрофильный атом углерода, кислорода, азота или серы ксенобиотика, формируется тиоэфир.Конъюгация ксенобиотиков с глютатионом катализируется суперсемейством глютатион-S-трансфераз (ГSТ). Эти белки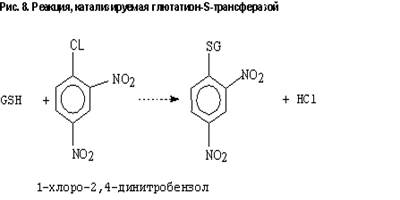 обнаружены в большинстве тканей, а именно в печени, почках, тонком кишечнике, легких и т.д. 95% от общего содержания фермента локализовано в цитоплазме и около 5% - в эндоплазматическом ретикулуме. Субстратами для ГSТ обычно являются гидрофобные соединения, содержащие электрофильный атом способные реагировать с глютатионом неферментативно. На рис. 8 представлена типичная реакция, катализируемая ГST. Однако, из-за стереоселективности реакций с ксенобиотиками, в основном они протекают при участии ГST. Механизм, с помощью которого ГST усиливает скорость конъюгации, состоит в депротонировании ГSH до ГS- . В этой реакции принимает участие тирозинат Tyr-O- , расположенный в активном центре. Субстраты для глютатионовой конъюгации можно разделить на две группы: 1) достаточно электрофильные для осуществления прямой конъюгации, 2) требующие активации до реакции конъюгации. 2-я группа соединений включает в себя оксиарены, эпоксиды алкенов, ионы нитрония, ионы карбония и свободные радикалы. ГST представляет собой димер, составленный из комбинации 2-х идентичных или неидентичных субъединиц. Описаны следующие генные семейства ГST, кодирующие цитозольные ферменты: alpha, mu, theta, pi, zeta. Классификация построена на основе структурных, иммунологических и функциональных свойств. Показано, что ГST, принадлежащие к различным классам, могут обладать перекрывающейся субстратной специфичностью. Субъединицы, принадлежащие к различным классам, имеют менее 50% гомологии аминокислотной последовательности. Субъединицы в пределах одного класса имеют около 70% гомологии. Гедеродимеры могут формироваться только при участии субъединиц, принадлежащих к одному классу. Семейства цитозольных ГST имеют общее эволюционное происхождение, причем -классу. Микросомальные формы фермента возникли изпредковый ген наиболее близок к отдельной эволюционной ветви. ГST представлены суперсемейством мультифункциональных изоферментов, которые способствуют процессам детоксикации, используя различные механизмы, включая 1) каталитическую инактивацию широкого спектра ксенобиотиков через конъюгацию с ГSH; 2) некаталитическое связывание определенных ксенобиотиков; 3) восстановление липид- и ДНК-гидропероксидов через экспрессию активности ГSH-пероксидазы 2. ГST играют важную роль в детоксикации Афлатоксин В1-8,9-эпоксида. Показано, что у грызунов отсутствие фермента, отвечающего за катализ этой реакции, связано с повышенной чувствительностью к раку печени. Интенсивно изучается метаболизм известного ПАУ – бенз[а]пирена (БП). Показано, что ГST печени человека обладают каталитической активностью по отношению к реактивному метаболиту БП – БП-4,5-оксиду. Это соединение дает позитивный ответ в тесте на мутагенность, хотя и не вовлекается напрямую в канцерогенез. Кроме метаболизма канцерогенов, ГST детоксицирует широкий спектр других ксенобиотиков, например фосфорорганические инсектициды, гербициды, пестициды, химиотерапевтические лекарства. Дополнительно к защитным свойствам, ГST участвует в биосинтезе биологически активных молекул, включая лейкотриены и простагландины.
обнаружены в большинстве тканей, а именно в печени, почках, тонком кишечнике, легких и т.д. 95% от общего содержания фермента локализовано в цитоплазме и около 5% - в эндоплазматическом ретикулуме. Субстратами для ГSТ обычно являются гидрофобные соединения, содержащие электрофильный атом способные реагировать с глютатионом неферментативно. На рис. 8 представлена типичная реакция, катализируемая ГST. Однако, из-за стереоселективности реакций с ксенобиотиками, в основном они протекают при участии ГST. Механизм, с помощью которого ГST усиливает скорость конъюгации, состоит в депротонировании ГSH до ГS- . В этой реакции принимает участие тирозинат Tyr-O- , расположенный в активном центре. Субстраты для глютатионовой конъюгации можно разделить на две группы: 1) достаточно электрофильные для осуществления прямой конъюгации, 2) требующие активации до реакции конъюгации. 2-я группа соединений включает в себя оксиарены, эпоксиды алкенов, ионы нитрония, ионы карбония и свободные радикалы. ГST представляет собой димер, составленный из комбинации 2-х идентичных или неидентичных субъединиц. Описаны следующие генные семейства ГST, кодирующие цитозольные ферменты: alpha, mu, theta, pi, zeta. Классификация построена на основе структурных, иммунологических и функциональных свойств. Показано, что ГST, принадлежащие к различным классам, могут обладать перекрывающейся субстратной специфичностью. Субъединицы, принадлежащие к различным классам, имеют менее 50% гомологии аминокислотной последовательности. Субъединицы в пределах одного класса имеют около 70% гомологии. Гедеродимеры могут формироваться только при участии субъединиц, принадлежащих к одному классу. Семейства цитозольных ГST имеют общее эволюционное происхождение, причем -классу. Микросомальные формы фермента возникли изпредковый ген наиболее близок к отдельной эволюционной ветви. ГST представлены суперсемейством мультифункциональных изоферментов, которые способствуют процессам детоксикации, используя различные механизмы, включая 1) каталитическую инактивацию широкого спектра ксенобиотиков через конъюгацию с ГSH; 2) некаталитическое связывание определенных ксенобиотиков; 3) восстановление липид- и ДНК-гидропероксидов через экспрессию активности ГSH-пероксидазы 2. ГST играют важную роль в детоксикации Афлатоксин В1-8,9-эпоксида. Показано, что у грызунов отсутствие фермента, отвечающего за катализ этой реакции, связано с повышенной чувствительностью к раку печени. Интенсивно изучается метаболизм известного ПАУ – бенз[а]пирена (БП). Показано, что ГST печени человека обладают каталитической активностью по отношению к реактивному метаболиту БП – БП-4,5-оксиду. Это соединение дает позитивный ответ в тесте на мутагенность, хотя и не вовлекается напрямую в канцерогенез. Кроме метаболизма канцерогенов, ГST детоксицирует широкий спектр других ксенобиотиков, например фосфорорганические инсектициды, гербициды, пестициды, химиотерапевтические лекарства. Дополнительно к защитным свойствам, ГST участвует в биосинтезе биологически активных молекул, включая лейкотриены и простагландины.
Дата добавления: 2019-09-30; просмотров: 839;











