Уридин дифосфатглюкуронозил трансферазы (УДT)
Глюкуронидация является основным путем биотрансформации ксенобиотиков у многих видов млекопитающих за исключением семейства кошачьих. Типичная реакция представлена на рис.7. В качестве кофактора эта реакция требует присутствия уридиндифосфоглюкуроновой кислоты (УДФ-глюкуроновая кислота). УДT локализуется в эндоплазматическом ретикулуме клеток печени и других тканей (почки, тонкий кишечник, селезенка, кожа, мозг и т.д.). Сайтом глюкуронидации обычно является электрон-богатый нуклеофильный атом кислорода, азота или серы. Субстраты для УДТ содержат такие функциональные группы как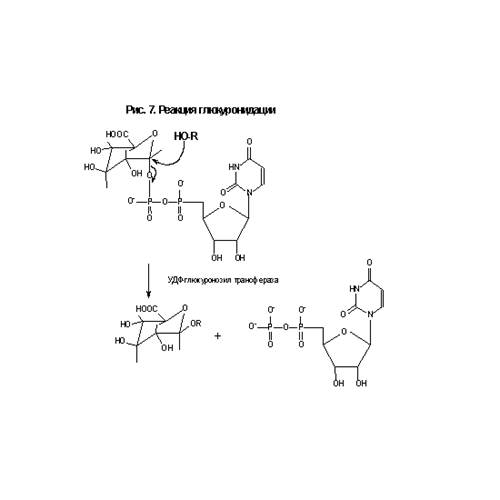 карбоксигруппу, спиртовую или фенольную (в результате реакции формируется О-глюкуроновый эфир), первичные или вторичные аминогруппы (N-глюкурониды) или свободную сульфгидрильную группу (S-глюкурониды). Субстратами для УДТ могут служить эндогенные соединения, типа билирубина, стероидных и тиреоидных гормонов. Глюкуроновые конъюгаты являются полярными соединениями, которые легко экскретируются с мочой или желчью, что зависит от размера агликона. Например, у крыс глюкурониды экскретируются с мочой, если молекулярная масса агликона менее 250 Да и с желчью, – если более 350 Да. Кофактор -конфигурацию, чтосинтезируется из глюкозо-1-фосфата и глюкуроновой кислоты и имеет -глюкуронидазами. В ходе нуклеофильной атаки на электрон-защищает его от гидролиза богатый атом кислорода, азота или серы происходит инверсия конфигурации, и разовавшиеся -конфигурацию.метаболиты имеют C-конец всех УДT содержит мембранно-связанный домен, который выполняет функцию якоря, закрепляя фермент в эндоплазматическом ретикулуме. Поскольку фермент обращен в сторону просвета эндоплазматического ретикулума, а синтез УДФ-глюкуроновой кислоты происходит в цитоплазме, то возникает проблема транспорта кофактора через эндоплазматический ретикулум. Постулируется, что транспорт УДФ-глюкуроновой кислоты в просвет ЭПР и УДФ в цитозоль происходит по челночному механизму. Глюкуронидация ксенобиотиков печеночными микросомами может быть стимулирована детергентами, которые разрывают липидный бислой, что обеспечивает УДT свободный доступ к УДФ-глюкуроновой кислоте. Однако, высокая концентрация детергента может ингибировать УДT, разрушая взаимодействия между ферментом и фосфолипидами. Недоступность кофактора может ограничить скорость глюкуронидации лекарств, назначаемых в высоких дозах. УДТ экспрессируется двумя генными семействами, УДT1 и УДT2, имеющими менее 50% гомологии аминокислотной последовательности. Ферменты, принадлежащие к 1-му семейству, участвуют в конъюгации фенолов, ариламинов, включая некоторые канцерогены, лекарств типа ацетаминофена, и билирубина, а ферменты 2-го семейства – стероидов. Члены 1-го семейства формируются путем альтернативного сплайсинга единственного гена. Множество ферментов, представляющих собой продукт УДT1-локуса, конструируются путем соединения отдельных субстрат-связывающих сайтов (кодируемых множественными копиями 1-го экзона), расположенных в N-концевой части, размером примерно в 280 аминокислотных остатков, с константной частью фермента, кодируемой экзонами 2-5. Константная область кодирует С-концевую часть в 245 аминокислотных остатков, которая отвечает за связывание кофактора и размещение в мембране. Таким образом, мутация в константной области может привести к синтезу абнормальных форм всех УДТ, кодируемых локусом 1. Например, показано, что у крыс Gunn мутация кодона 415 локуса 1 может приводить к преждевременному появлению стоп-сигнала. При этом синтезируются укороченные и функционально неактивные формы УДТ. Известно, что у крыс локус 1 кодирует УДT, индуцируемую 3-метилхолантреном и ТХДД. УДT1А6 включается в конъюгацию ПАУ, ацетаминофена и ариламинов. В экстрапеченочных тканях обнаружена конститутивная экспрессия этого фермента. Регуляция активности этого фермента может осуществляться, по крайней мере, двумя способами, включая тканеспецифичную и AhR-контролируемую экспрессию. В регуляторной области 1А6 обнаружен XRE, который связывается с AhR и Arnt–белками. Члены 2-го семейства кодируются двумя отдельными генами, причем 2А экспрессируется в кожном эпителии, а 2В – в микросомах печени. Субстратами для них являются стероидные гормоны. Кроме того, показано, что УДТ 2В семейства могут участвовать в метаболизме ряда ксенобиотиков, включая морфий, а также метаболитов канцерогенов, 2-ацетиламинофлуорена и бенз[а]пирена. У крыс 2 фермента из семейства 2В индуцируются ФБ. Глюкуронидация обычно представляет собой детоксикационный процесс, однако стероидные гормоны, которые взаимодействуют с глюкуронидом по Д-кольцу (но не по А-) могут приводить к возникновению холестазии. Индукция УДT может влиять на возникновение рака щитовидной железы у грызунов. В некоторых случаях глюкуронидация может усилить токсичность ксенобиотика. Например, ароматические амины типа 2-аминонафталена и 4-аминобифенила N-гидроксилируются в печени с последующей N-глюкуронидацией N-гидрокси метаболита. N-глюкурониды подвергаются почечной фильтрации, накапливаясь в полости мочевого пузыря, где при кислых значениях рН происходит их гидролиз до соответствующих канцерогенных N-гидроксиариламинов. В таком случае усиление глюкуронизации может способствовать возникновению рака мочевого пузыря.
карбоксигруппу, спиртовую или фенольную (в результате реакции формируется О-глюкуроновый эфир), первичные или вторичные аминогруппы (N-глюкурониды) или свободную сульфгидрильную группу (S-глюкурониды). Субстратами для УДТ могут служить эндогенные соединения, типа билирубина, стероидных и тиреоидных гормонов. Глюкуроновые конъюгаты являются полярными соединениями, которые легко экскретируются с мочой или желчью, что зависит от размера агликона. Например, у крыс глюкурониды экскретируются с мочой, если молекулярная масса агликона менее 250 Да и с желчью, – если более 350 Да. Кофактор -конфигурацию, чтосинтезируется из глюкозо-1-фосфата и глюкуроновой кислоты и имеет -глюкуронидазами. В ходе нуклеофильной атаки на электрон-защищает его от гидролиза богатый атом кислорода, азота или серы происходит инверсия конфигурации, и разовавшиеся -конфигурацию.метаболиты имеют C-конец всех УДT содержит мембранно-связанный домен, который выполняет функцию якоря, закрепляя фермент в эндоплазматическом ретикулуме. Поскольку фермент обращен в сторону просвета эндоплазматического ретикулума, а синтез УДФ-глюкуроновой кислоты происходит в цитоплазме, то возникает проблема транспорта кофактора через эндоплазматический ретикулум. Постулируется, что транспорт УДФ-глюкуроновой кислоты в просвет ЭПР и УДФ в цитозоль происходит по челночному механизму. Глюкуронидация ксенобиотиков печеночными микросомами может быть стимулирована детергентами, которые разрывают липидный бислой, что обеспечивает УДT свободный доступ к УДФ-глюкуроновой кислоте. Однако, высокая концентрация детергента может ингибировать УДT, разрушая взаимодействия между ферментом и фосфолипидами. Недоступность кофактора может ограничить скорость глюкуронидации лекарств, назначаемых в высоких дозах. УДТ экспрессируется двумя генными семействами, УДT1 и УДT2, имеющими менее 50% гомологии аминокислотной последовательности. Ферменты, принадлежащие к 1-му семейству, участвуют в конъюгации фенолов, ариламинов, включая некоторые канцерогены, лекарств типа ацетаминофена, и билирубина, а ферменты 2-го семейства – стероидов. Члены 1-го семейства формируются путем альтернативного сплайсинга единственного гена. Множество ферментов, представляющих собой продукт УДT1-локуса, конструируются путем соединения отдельных субстрат-связывающих сайтов (кодируемых множественными копиями 1-го экзона), расположенных в N-концевой части, размером примерно в 280 аминокислотных остатков, с константной частью фермента, кодируемой экзонами 2-5. Константная область кодирует С-концевую часть в 245 аминокислотных остатков, которая отвечает за связывание кофактора и размещение в мембране. Таким образом, мутация в константной области может привести к синтезу абнормальных форм всех УДТ, кодируемых локусом 1. Например, показано, что у крыс Gunn мутация кодона 415 локуса 1 может приводить к преждевременному появлению стоп-сигнала. При этом синтезируются укороченные и функционально неактивные формы УДТ. Известно, что у крыс локус 1 кодирует УДT, индуцируемую 3-метилхолантреном и ТХДД. УДT1А6 включается в конъюгацию ПАУ, ацетаминофена и ариламинов. В экстрапеченочных тканях обнаружена конститутивная экспрессия этого фермента. Регуляция активности этого фермента может осуществляться, по крайней мере, двумя способами, включая тканеспецифичную и AhR-контролируемую экспрессию. В регуляторной области 1А6 обнаружен XRE, который связывается с AhR и Arnt–белками. Члены 2-го семейства кодируются двумя отдельными генами, причем 2А экспрессируется в кожном эпителии, а 2В – в микросомах печени. Субстратами для них являются стероидные гормоны. Кроме того, показано, что УДТ 2В семейства могут участвовать в метаболизме ряда ксенобиотиков, включая морфий, а также метаболитов канцерогенов, 2-ацетиламинофлуорена и бенз[а]пирена. У крыс 2 фермента из семейства 2В индуцируются ФБ. Глюкуронидация обычно представляет собой детоксикационный процесс, однако стероидные гормоны, которые взаимодействуют с глюкуронидом по Д-кольцу (но не по А-) могут приводить к возникновению холестазии. Индукция УДT может влиять на возникновение рака щитовидной железы у грызунов. В некоторых случаях глюкуронидация может усилить токсичность ксенобиотика. Например, ароматические амины типа 2-аминонафталена и 4-аминобифенила N-гидроксилируются в печени с последующей N-глюкуронидацией N-гидрокси метаболита. N-глюкурониды подвергаются почечной фильтрации, накапливаясь в полости мочевого пузыря, где при кислых значениях рН происходит их гидролиз до соответствующих канцерогенных N-гидроксиариламинов. В таком случае усиление глюкуронизации может способствовать возникновению рака мочевого пузыря.
Дата добавления: 2019-09-30; просмотров: 1088;











