Классификации экзотоксинов
По молекулярной организации экзотоксины делятся на 2 группы:
– состоящие из двух фрагментов — имеют бифункциональную АВ-структуру: ферментативно активная субъединица А (активатор, имеет большую молекулярную массу) нековалентно связана с транспортной субъединицей В (имеет меньшую молекулярную массу), непосредственно взаимодействующей со специфическим рецептором клетки-мишени. Токсическая группа А проникает внутрь клетки и блокирует метаболические реакции. Высокая токсичность белковых токсинов объясняется особенностью строения участков их молекул, имитирующих структуру макромолекул организма, поэтому по механизму действия они являются антиметаболитами. Типичную АВ–структуру имеют ST–токсины, термолабильный токсин E.coli, холерный токсин и экзотоксин бордетеллы коклюша;
– составляющие единую полипептидную цепь. Нейротоксины синтезируются в виде неактивных полипептидов с молекулярной массой до 150 кДа. Они высвобождаются при лизисе бактериальной клетки и активируются путем протеолитического расщепления незащищенной петли полипептида. Каждая активная молекула нейротоксина состоит из тяжелой (100 кДа) и легкой (50 кДа) цепочек, соединенных единичной бисульфидной связью. Тяжелая цепочка нейротоксинов содержит два домена: участок, ответственный за транслокацию токсина и область, регулирующую связывание токсина с клеткой. Легкие цепочки нейротоксинов содержат цинксвязывающие последовательности, необходимые для осуществления протеазной активности токсина, зависящей от ионов цинка.
По степени связи с бактериальной клетки экзотоксины делятся на 3 класса:
– секретируемые во внешнюю среду (гистотоксин C. diphteriae; отечный, летальный токсин B. anthracis);
– частично секретируемые и частично связанные с микроорганизмом (тетаноспазмин C. tetani, нейротоксин C. botulinum).
– связанные с микроорганизмом и попадающие в окружающую среду при разрушении клетки (цито-, энтеро-, нейротоксин S. dysenteriae, «мышиный» токсин Y. pestis).
По механизму действия бактериальные токсины делятся на 6 групп(табл. 41):
1) мембранотоксины, повреждающие клеточные мембраны —вызывают разрушение клеток в результате формирования пор (рис. 80 А). Формируя трансмембранные поры, они нарушают селективный вход и выход ионов через плазматическую мембрану (RTX–токсины Грам- бактерий, a–токсин C. perfringens, стрептолизин S. pyogenes, a–токсин S. aureus (одна из фракций экзотоксина, лейкоцидин)).
a–токсин обладает цитолитическими свойствами в отношении различных типов клеток (моноцитов, лимфоцитов, эритроцитов, тромбоцитов, эндотелиоцитов). Стадии повреждения клеточной мембраны под действием a–токсина:
– протомеры токсина связываются с мембраной клетки-мишени при помощи рецепторов или неспецифически абсорбируются фосфотидилхолином или холестеролом, входящими в состав билипидного слоя мембраны,
– связанные с мембраной протомеры олигомеризуются в нелитический гептамерный комплекс,
– гептамер претерпевает ряд конформационных изменений, в результате формируется «ножка», которая проникает сквозь ЦПМ. Через образовавшуюся пору происходит вход и выход небольших молекул и ионов, что ведет к набуханию и гибели ядерных клеток и осмотическому лизису эритроцитов.
При образовании пор также запускаются вторичные процессы (активация эндонуклеаз, увеличение экзоцитоза тромбоцитов, высвобождение цитокинов и медиаторов воспаления, выделение эйкозаноидов), которые могут обусловливать развитие патологических последствий.
2) ингибирующие белковый синтез — субстратами для этих токсинов являются фактор элонгации и рибосомальная РНК (рис. 80 В). Подавление белкового синтеза приводит в конечном итоге к гибели клетки-мишени.
Дифтерийный токсин и экзотоксин А Pseudomonas вызывают АДФ–рибозилирование фактора элонгации, нарушая синтез белка.
S. dysenteriae серотипа 1 и E. coli вырабатывают ST–токсины, инактивирующие рибосомальную РНК и нарушающие ее взаимодействие с факторами элонгации. ST–токсины являются мощными цитотоксинами.
3) активирующие пути метаболизма, контролируемые вторичными мессенджерами (англ. message — сообщение) — нарушают синтез различных клеточных белков, не вызывая непосредственной гибели клеток (рис. 80 С). Активация или модификация вторичных мессенджеров под действием токсинов обуславливает нарушения процессов передачи сигналов, имеющих значение в поддержании разнообразных функций клеток (функциональные блокаторы).
Цитотоксический некротизирующий фактор (CNF) E. coli активирует Rho–белки, которые являются регуляторами актинового цитоскелета, и играет важную роль в развитии внекишечных инфекций (особенно инфекций мочевыводящих путей). Дермонекротический токсин Bordetella spp. также активирует Rho. Клостридиальные цитотоксины инактивируют Rho.
Холероподобные токсины обнаружены у V. сhоlerae, НАГ–вибрионов,патогенной E. coli (LT–энтеротоксин), С. Jejuni. Они взаимодействуют с энтероцитами, что ведет к активации аденилатциклазы, накоплению цАМФ, увеличению проницаемости стенки тонкой кишки, выведению воды и электролитов в просвет кишечника, что приводит к диарее и обезвоживанию. Сибиреязвенный и чумной токсины также инактивируют аденилатциклазу.
Термостабильные ST–энтеротоксины обнаружены у энтеротоксигенных штаммов Е. coli (ЭТКП), К. pneumoniae, Y. enterocolitica, Y. pseudotuberculosis, ониактивируют гуанилатциклазу, которая превращает внутриклеточный ГМФ в эпителиальных клетках в цГМФ. Увеличение концентрации цГМФ нарушает транспорт электролитов в кишечнике: подавляется абсорбция ионов натрия и повышается секреция ионов хлора, изменения ионных потоков приводят к развитию секреторной диареи. ЭТКП вызывают диарею путешественников и являются основным этиологическим фактором диарей у детей во всем мире.
НейротоксиныC. botulinum и C. tetani имеют сходную структуру, ферментативную активность, избирательно действуют на нервную систему; не вызывают видимых повреждений нервных клеток. Клеточными мишенями нейротоксинов является группа белков, необходимых для стыковки и соединения синаптических пузырьков с пресинаптическими плазматическими мембранами с последующим высвобождением нейромедиаторов. Ингибируя высвобождение нейромедиаторов, нейротоксиныблокируют передачу нервных импульсов в клетках головного и спинного мозга. Таким образом, они блокируют функции жевания, глотания, дыхания.
Ботулотоксины вызывают ботулизм новорожденных и пищевой ботулизм, они существуют в виде больших комплексов, включающих нейротоксин и один или несколько белков, которые обеспечивают защиту и стабильность молекулы токсина в ЖКТ. Ботулотоксины связываются с рецепторами на пресинаптической мембране моторных нейронов периферической нервной системы. Протеолиз белков-мишеней в этих нейронах ингибирует высвобождение ацетилхолина, препятствуя мышечным сокращениям.
Столбнячный экзотоксин (тетаноспазмин), синтезируемый в ранах вегетативными формами C. tetani, не формирует комплексов с белками. Он действует на ЦНС, поражая два вида нейронов: первоначально связывается с рецепторами пресинаптической мембраны моторных нейронов, затем с помощью обратного везикулярного транспорта перемещается в спинной мозг, где может внедриться в тормозные и вставочные нейроны. Расщепление везикулоассоциированного мембранного протеина в этих нейронах приводит к высвобождению глицина и g–аминомасляной кислоты, которые вызывают мышечные сокращения.
Различия в клинических проявлениях интоксикации ботулотоксином (пониженный тонус мышц) и столбнячным экзотоксином (спастический паралич) являются следствием воздействия данных токсинов на различные нейроны.
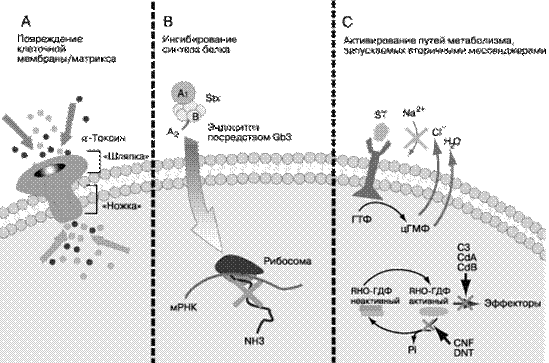
Рис. 80. Механизмы действия некоторых бактериальных токсинов:
A – повреждение клеточных мембран под действием a–токсина S.aureus.
B – ингибирвание синтеза белка токсином Шига (Stx).
C – активация вторичных мессенджеров (ST–энтеротоксины, экзотоксин C.botulinum (С3) и токсины А и В C.difficile (CdA и CdB), цитотоксический некротизирующий фактор (CNF) E. coli и дермонекротический токсин (DNT) Bordetella spp.)
4) суперантигены, активирующие иммунный ответ макроорганизма (стафилококковые энтеротоксины серотипов A–E, G и H, пирогенные экзотоксины стрептококков группы А (серотипы A–C и F), суперантиген стрептококков группы А и стафилококковый суперантиген). Эти белковые молекулы напрямую связваются с рецепторами Т–лимфоцитов, что приводит к массивной пролиферации Т–лимфоцитов, которая сопровождается массивным высвобождением лимфоцитарных (ИЛ2, ФНО, g–интерферон) и моноцитарных (ИЛ1, ИЛ6, ФНО) цитокинов. Цитокины вызывают гипотензию, высокую температуру тела и диффузную эритематозную сыпь.
Суперантигены термостабильны, имеют сходную биологическую активность. Стафилококковый суперантиген рассматривают как ключевую субстанцию в развитии синдрома стафилококкового токсического шока, в последние годы его стали связывать и с развитием синдрома Кавасаки — одной из причин приобретенных пороков сердца у детей.
5) эксфолиатины S. aureus,влияющие на процесс взаимодействия клеток между собой и с межклеточными веществами— вызывают пузырчатку новорожденных (отслоение эпидермиса и образование сливающихся пузырей, жидкость в которых стерильна; фокус стафилококковой инфекции находится при этом вдали от места кожного повреждения, чаще всего в пупочной ранке);
6) эритрогенины S. pyogenes, вызывающие сыпь при скарлатине и покраснение кожи при внутрикожном введении восприимчивым людям.
Таблица 41
Дата добавления: 2021-02-19; просмотров: 747;











