РАСПРЕДЕЛЕНИЕ БОЛЬЦМАНА
Воспользуемся полученной нами ранее барометрической формулой:
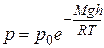 (9.16)
(9.16)
и получим зависимость концентрации молекул от высоты. Поскольку
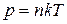 ,
, 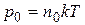 и
и 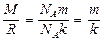 , то
, то
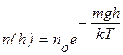 (9.17)
(9.17)
 Если изобразить графики зависимостей
Если изобразить графики зависимостей 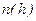 в соответствии с (9.17) при различных температурах, то легко видеть, что с понижением температуры основная часть молекул располагается ближе к поверхности Земли. При абсолютном нуле все молекулы должны были бы расположиться на поверхности. Наоборот, при высоких температурах молекулы располагаются почти равномерно.
в соответствии с (9.17) при различных температурах, то легко видеть, что с понижением температуры основная часть молекул располагается ближе к поверхности Земли. При абсолютном нуле все молекулы должны были бы расположиться на поверхности. Наоборот, при высоких температурах молекулы располагаются почти равномерно.
Конкретное распределение молекул устанавливается в результате действия противоположных факторов: сила притяжения концентрирует молекулы вблизи поверхности, а тепловое движение разбрасывает по всем высотам.
В числителе показателя степени экспоненты (9.17) стоит фактически энергия молекулы в поле силы тяжестиεр. Поэтому (9.17) можно записать в виде
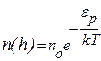 (9.18)
(9.18)
Больцман доказал, что распределение (9.18) справедливо для совокупности любых одинаковых частиц, находящихся в тепловом движении в любом потенциальном поле. Поэтому распределение (18) называют распределением Больцмана. Это распределение можно представить в виде
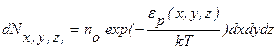 (9.19)
(9.19)
где 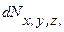 – количество молекул, попадающих в пределы объема
– количество молекул, попадающих в пределы объема 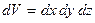 , расположенного в точке с координатами x, y, z.
, расположенного в точке с координатами x, y, z.
Это распределение можно объединить с распределением Максвелла, выделив из 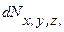 молекулы, компоненты скорости которых лежат в пределах от
молекулы, компоненты скорости которых лежат в пределах от 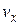 до
до 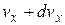 ,от
,от 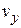 до
до 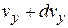 , от
, от 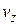 до
до 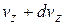 :
:
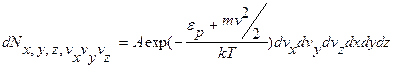 (9.20)
(9.20)
Очень часто энергия частиц может только дискретные значения из ряда: 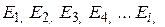 . В этом случае распределение Больцмана дает количество частиц
. В этом случае распределение Больцмана дает количество частиц 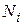 , которые находятся в состоянии с энергией
, которые находятся в состоянии с энергией 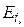 и имеет вид:
и имеет вид:
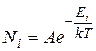 (9.21)
(9.21)
где 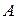 – коэффициент пропорциональности, который определяется из условия нормировки. В этом случае условие нормировки сводится к требованию того, чтобы сумма частиц во всех состояниях была равна общему количеству частиц в системе:
– коэффициент пропорциональности, который определяется из условия нормировки. В этом случае условие нормировки сводится к требованию того, чтобы сумма частиц во всех состояниях была равна общему количеству частиц в системе:
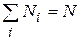 (9.22)
(9.22)
Найдем значение нолрмирующего множителя, подставив (9.21) в (9.22):
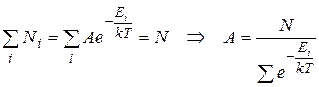 (9.23)
(9.23)
Таким образом, окончательно распределение Больцмана для систем с дискретными разрешенными значениями энергии можно записать в виде:
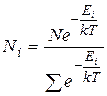 (9.24)
(9.24)
СТАТИСТИЧЕСКИЙ ВЕС
Понятие «статистический вес» (используется также термин термодинамическая вероятность) является одним из основных в статистической физике. Чтобы сформулировать его определение необходимо сначала определить понятия макросостояние и микросостояние.
Одно и тоже состояние макроскопического тела можно охарактеризовать по-разному. Если состояние охарактеризовано заданием макроскопических параметров состояния (давление, объем, температура, плотность и т.п.) то такое состояние будем называть макросостоянием.
Если состояние охарактеризовано путем задания координат и скоростей всех молекул тела, то такое состояние будем называть микросостоянием.
Очевидно, что одно и то же макросостояние может быть реализовано различными способами, то есть различными микросостояниями. Число различных микросостояниий, которыми может быть реализовано данное макросостояние называется статистическим весом или термодинамической вероятностью.
 Для пояснения указанных понятий рассмотрим модель (!) - сосуд, в котором находятся N молекул. Предположим, что сосуд разделен на две одинаковые части, и различные макросостояния отличаются количеством молекул в левой и правой половинах сосуда. Поэтому в рамках модели будем считать состояние молекулы заданным, если известно, в какой из половин сосуда она находится.
Для пояснения указанных понятий рассмотрим модель (!) - сосуд, в котором находятся N молекул. Предположим, что сосуд разделен на две одинаковые части, и различные макросостояния отличаются количеством молекул в левой и правой половинах сосуда. Поэтому в рамках модели будем считать состояние молекулы заданным, если известно, в какой из половин сосуда она находится.
Различные микросостояния отличаются при этом тем, какие именно молекулы находятся справа и слева. 1,2 – 3,4 (как показано на рисунке 9.5) одно из состояний. 1,3 – 2,4 – другое микросостояние.
Каждая из молекул может с равной вероятностью находиться и слева, и справа. Поэтому вероятность i-той молекуле находиться, например, справа равна ½. Появление в левой части сосуда  той молекулы наряду с
той молекулы наряду с  той является статистически независимым событием, поэтому вероятность нахождения слева двух молекул равна ½ ½ = ¼; трех молекул – 1/8; четырех – 1/16 и т.д. Следовательно, вероятность любого размещения (микросостояния) молекул равна
той является статистически независимым событием, поэтому вероятность нахождения слева двух молекул равна ½ ½ = ¼; трех молекул – 1/8; четырех – 1/16 и т.д. Следовательно, вероятность любого размещения (микросостояния) молекул равна 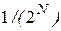 .
.
Утверждение о том, что, вероятности каждого их микросостояний равны, называются эргодической гипотезой, и оно лежит в основе статистической физики.
Рассмотрим N = 4. Каждое из размещений молекул в половинах сосуда является конкретным микросостоянием. Тогда макросостоянию с числом молекул слева 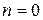 соответствует 1 микросостояние. Статистический вес такого макросостояния равен 1, а вероятность его реализации – 1/16. Для иных макростоляний можно утверждать следующее:
соответствует 1 микросостояние. Статистический вес такого макросостояния равен 1, а вероятность его реализации – 1/16. Для иных макростоляний можно утверждать следующее:
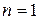 соответствует 4 микросостояния статистический вес 4, 4/16
соответствует 4 микросостояния статистический вес 4, 4/16
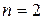 соответствует 6 микросостояний статистический вес 6, 6/16
соответствует 6 микросостояний статистический вес 6, 6/16
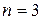 соответствует 4 микросостояния статистический вес 4, 4/16
соответствует 4 микросостояния статистический вес 4, 4/16
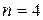 соответствует 1 микросостояние статистический вес 1, 1/16
соответствует 1 микросостояние статистический вес 1, 1/16
Теперь можно видеть, что вследствие принятия эргодической гипотезы, статистический вес оказывается пропорциональным вероятности (обычной!) реализации данного макросостояния.
Если в сосуде содержится N молекул, то можно доказать, что статвес макросостояния, заключающегося в том, что слева n молекул, а справа (N – n)
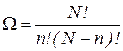 (9.25)
(9.25)
Если для четырех молекул вероятность собраться в одной из половин сосуда составляет 1/16, то есть вполне ощутимую величину, то уже для N = 24 эта вероятность составляет порядка 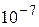 .
.
При нормальных условиях в 4 см3 воздуха содержится около 1020 молекул. Вероятность собраться им в одной из частей сосуда оценивается величиной 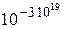 .
.
Таким образом, с увеличением количества молекул в системе вероятность существенных отклонений от приблизительного равенства количеств молекул в частях сосуда очень быстро убывает. Это соответствует тому, что статвес состояний с приблизительно равным количеством молекул в половинах оказывается очень большим и быстро убывает по мере отклонения от равенства молекул в частях.
Если число N не очень велико, то с течением времени наблюдаются – заметные отклонения количества молекул в одной из половины от N / 2. Случайные отклонения физической величиныx 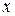 от ее среднего значения
от ее среднего значения 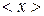 называются флуктуациям:
называются флуктуациям:
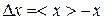 . (9.26)
. (9.26)
Среднее арифметическое абсолютной флуктуации 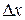 равно нулю. Поэтому в качестве характеристики флуктуаций чаще рассматривают среднюю квадратичную флуктуацию:
равно нулю. Поэтому в качестве характеристики флуктуаций чаще рассматривают среднюю квадратичную флуктуацию:
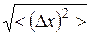 . (9.27)
. (9.27)
Более удобной и показательной является относительная флуктуация:
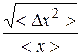 . (9.28)
. (9.28)
Причем в статистической физике доказывается соотношение:
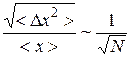 , (9.28)
, (9.28)
т.е. величина относительной флуктуации обратно пропорционально корню из количества частиц в системе. Это утверждение подтверждает наш качественный вывод.
Аналогично количеству молекул в одной из половин сосуда флуктуируют вблизи средних значений и другие макроскопические характеристики состояния – давление, плотность, и т.п.
Рассмотрим природу равновесных и неравновесных состояний и процессов с точки зрения статистической физики. Равновесным, по определению, является такое состояние, которое не имеет тенденции к изменению с течением времени. Ясно, что таким свойством в наибольшей мере будет обладать наиболее вероятное из всех макросостояний системы, то есть состояние, реализуемое наибольшим количеством микросостояний, а значит обладающее наибольшим статистическим весом. Поэтому равновесное состояние можно определить как состояние, статвес которого максимален.
Примером типичного необратимого процесса может служить распространение на весь объем сосуда молекул газа, первоначально сосредоточенных в одной из его половин. Этот процесс является необратимым, так как вероятность того, что в результате теплового движения все молекулы соберутся в одной из половин сосуда, очень мала. Соответственно всегда необратимым является процесс, обратный которому крайне маловероятен.

 ЛЕКЦИЯ № 10 СТАТИЧЕСКАЯ ФИЗИКА И ТЕРМОДИНАМИКА
ЛЕКЦИЯ № 10 СТАТИЧЕСКАЯ ФИЗИКА И ТЕРМОДИНАМИКА
10.1. ЭНТРОПИЯ
Как мы установили, вероятность состояния системы пропорциональна ее статическому весу, поэтому в качестве характеристики вероятности состояния можно было бы использовать сам статвес W. Однако W не является аддитивной величиной. Поэтому для характеристики состояния системы используют величину
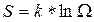 (1)
(1)
которую называют энтропией системы. Действительно, если мы рассмотрим две системы по 4 молекулы в каждой, то статистический вес состояния, когда в каждой из подсистем находится, например, по одной молекуле слева будет равен 16, т.е. 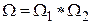 . Это соотношение справедливо для любых состояний. Следовательно, статвес неаддитивен. В то же время энтропия состояния результирующей системы
. Это соотношение справедливо для любых состояний. Следовательно, статвес неаддитивен. В то же время энтропия состояния результирующей системы 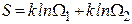 т.е. является величиной аддитивной.
т.е. является величиной аддитивной.
Поскольку при протекании необратимых процессов в изолированной системе она переходит из менее вероятных в более вероятные состояния, можно утверждать, что энтропия изолированной системы возрастает при протекании в ней необратимых процессов.
Равновесное состояние является наиболее вероятным состоянием, а значит, энтропия системы перешедшей в равновесное состояние максимальна.
Поэтому можно утверждать, что энтропия изолированной системы остается постоянной, если она находится в равновесном состоянии, или возрастает, если в ней протекают необратимые процессы.
Утверждение о том, что энтропия изолированной системы не убывает, называетсявторым началом термодинамики или законом возрастания энтропии.
Энтропия является, очевидно, функциейсостояния и должна определятся параметрами состояния. Самыми простыми свойствами обладает одноатомный идеальный газ – его состояния полностью определяется заданием двух параметров, например, температуры и объема. Соответственно его энтропию можно определить как функцию температуры и объема: 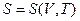 . Соответствующие вычисления показывают, что энтропия моля идеального газа определяется выражением
. Соответствующие вычисления показывают, что энтропия моля идеального газа определяется выражением
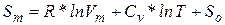 (2)
(2)
где 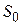 - есть некоторая константа, с точностью до которой определяется энтропия.
- есть некоторая константа, с точностью до которой определяется энтропия.
Теперь можно выяснить вопрос о том, как изменяется энтропия неизолированной системы, например при сообщении ей некоторого количества тепла 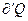 . Возьмем дифференциал (2) и умножим его на
. Возьмем дифференциал (2) и умножим его на 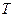 :
:
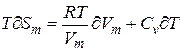 (3)
(3)
Но 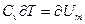 приращению внутренней энергии газа. Поскольку равенство
приращению внутренней энергии газа. Поскольку равенство 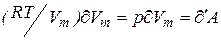 .Тогда (3) преобразуется к виду:
.Тогда (3) преобразуется к виду:
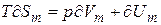 (4)
(4)
Входящие в (4) 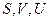 являются аддитивными, и поэтому (4) справедливо для любой массы газа:
являются аддитивными, и поэтому (4) справедливо для любой массы газа:
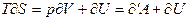 (5)
(5)
Согласно первому началу термодинамики правая часть(5) есть 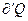 . По этому:
. По этому:
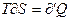 и
и 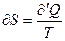 (6)
(6)
Формула(6) оказывается справедливой для любых тел, необходимо только чтобы сообщение количества тепла 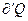 было обратимым.
было обратимым.
Остановимся на физической сущности энтропии.
Введем определения: состояние, осуществляемое относительно малым числом способов будет называться упорядоченным или неслучайным. Состояние, осуществляемое большим количеством способов – беспорядочным или случайным.
Тогда можно утверждать, что энтропия является количественной мерой степени беспорядка в системе. Сообщение системе количества тепла приводит к усилению теплового движения молекул, а значит и к росту энтропии. При этом, чем выше температура системы, тем меньше доля беспорядка вносимого сообщением данного  , в чем и заключается физический смысл формулы(6).
, в чем и заключается физический смысл формулы(6).
Если количество тепла сообщается системе в ходе необратимого процесса, то ее энтропия возрастает не только за счет получения тепла, но и за счет протекания необходимых процессов, поскольку необратимый процесс сопровождается ростом вероятности состояния системы, ее статистического веса
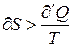 (7)
(7)
В этом случае под 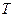 в(7) подразумевается температура резервуара, из которого система получает
в(7) подразумевается температура резервуара, из которого система получает 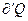 . Объединяя (6) и(7) вместе можно записать:
. Объединяя (6) и(7) вместе можно записать:
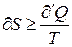 (8)
(8)
При абсолютном нуле всякая система находится в основном состоянии, т. е. состоянии с наименьшей энергией. Статический вес этого вполне определенного состояния равен единице, а значит энтропия системы равна нулю. Это соответствует теореме Нернста, согласно которой энтропия всякого тела стремится к нулю при стремлении к нулю его температуры:
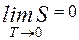
Теорему Нернста называют также третьим началом термодинамики.
Дата добавления: 2017-01-26; просмотров: 1963;











