Б) Нуклеофильные свойства
Пиридин, как третичный амин, легко алкилируется с образованием N-алкилпиридиниевых солей. В этой реакции пиридин выступает в качестве нуклеофила. Продукты реакции – галогеноалкилаты:
 |  |
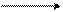 + CH3J
+ CH3J
 |  |

 N иодметан N J
N иодметан N J
•• CH3
пиридин N-метилпиридинийиодид
(иодметилат пиридина)
Алкилы в галогеноалкилатах могут переходить в α- или γ-положения кольца:
 | |||
 | |||
 J
J




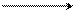 NH CH3
NH CH3
α-метилпиридиний иодистый

 CH3
CH3









 N J
N J
 CH3 J
CH3 J
N-метилпиридинийиодид 


(иодметилат пиридина) NH
γ-метилпиридиний иодистый
Нуклеофильные свойства пиридина подтверждаются и легкостью образования N-ацилпиридиниевых солей. Такие соли образуются в качестве интермедиатов в реакциях О-ацилирования карбоновых кислот хлорангидридами в присутствии пиридина.
2) Электрофильное ароматическое замещение -SEAr
Вследствие пониженной π-электронной плотности в цикле пиридин подвергается реакциям электрофильного замещения лишь в жестких условиях. При этом следует иметь в виду, что пиридиновый цикл еще более дезактивируется к электрофильной атаке из-за протонирования атома азота. Такое протонирование, безусловно, имеет место в присутствии сильных минеральных кислот, применяемых в указанных ниже реакциях. В присутствии кислот образуется катион пиридина, что приводит к еще большей дезактивации кольца к электрофилам:
 |  |

 + H+
+ H+



N NH
••




 SO3H
SO3H
 20%-олеум + H2O
20%-олеум + H2O
2300С, 24 ч
N
пиридин-3-сульфокислота





 NO2
NO2
KNO3 + H2O
 N H2SO4, 3000C
N H2SO4, 3000C
•• N
3-нитропиридин
Br



 Br2 + HBr
Br2 + HBr
 200-2500C
200-2500C
N
3-бромпиридин
RCOCl или RX
 AlCl3 реакция не идет
AlCl3 реакция не идет
Преимущественная ориентация электрофильного агента в положение 3 объясняется тем, что при такой ориентации положительный заряд в промежуточном σ-комплексе не локализован на электроотрицательном атоме азота, о чем свидетельствуют наборы резонансных структур, отвечающих атакам молекулы пиридина соответственно в положения 2, 3 и 4. Лишь атака в положение 3 не ведет к крайне невыгодной локализации положительного заряда на электроноакцепторном атоме азота.
В первую очередь электрофильные реагенты атакуют атом азота, образуя на нем электроположительный центр. σ-Комплексы, требующие возникновения в молекуле второго электроположительного центра на атоме азота, малоустойчивы (отталкивание одноименных зарядов). Это происходит при α- и γ-замещениях; при β-замещении второй электроположительный центр не локализуется на атоме азота, что влияет на большую энергетическую устойчивость образующегося σ-комплекса:
Атака в положение 2:
 |  |













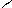



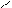













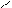




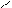 E+
E+

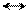

 + E+ H H H
+ E+ H H H

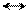



N NE NE E NE E NE E

 •• резонансные структуры σ-комплекса при α-замещении
•• резонансные структуры σ-комплекса при α-замещении
неустойчивая структура
Атака в положение 4:










 Н Е Н Е Н Е
Н Е Н Е Н Е










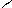


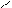






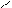 E+
E+
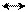
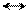





 + E+
+ E+













N NE NE NE NE
 •• резонансные структуры σ-комплекса при γ-замещении
•• резонансные структуры σ-комплекса при γ-замещении
неустойчивая структура
Атака в положение 3:




























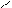





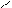





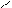 E+ Н Н Н
E+ Н Н Н
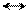






 + E+ Е Е Е
+ E+ Е Е Е



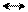

N NE NE NE NE
 •• резонансные структуры σ-комплекса при β-замещении
•• резонансные структуры σ-комплекса при β-замещении
Дата добавления: 2017-01-16; просмотров: 2161;











