В) Взаимодействие с ангидридами карбоновых кислот










 COCOCl
COCOCl

 3
3
NH3




 2 + (COCl)2 –HСl –HСl
2 + (COCl)2 –HСl –HСl

 N1 N
N1 N
H H
индол хлористый ангидрид индолил хлорангидрид
щавелевой кислоты двузамещенный щавелевой кислоты
(3-(хлороксалил)индол)















 COCONH2CH2CH2NH2
COCONH2CH2CH2NH2

 LiAlH4
LiAlH4
 –2H2O
–2H2O

 NN
NN
H H
индолиламид щавелевой кислоты триптамин
(3-(амидоксалил)индол) (3-(2′-аминоэтил)индол)
Некоторые β-замещенные индола являются биологически активными веществами, выполняющими ответственные функции в животных организмах.
Так, триптофан, незаменимая α-аминокислота в цепи биохимических превращений, в результате окислительного декарбоксилирования превращается в 5-окситриптамин – серотонин – важнейший биогенный амин. Серотонин, являясь медиатором нервных импульсов, участвует в процессе передачи нервного возбуждения центральной нервной системы и регуляции психической деятельности.
Антагонистом серотонина является диэтиламид лизергиновой кислоты, выделенной впервые из алкалоидов спорыньи (препарат LSD – 25), который вытесняет серотонин из его рецепторов (опасный наркотик – причина появления слуховых, зрительных галлюцинаций, потери чувства собственной личности). LSD – 25, охарактеризованный впервые в 1943 г., биогенетически связан с триптофаном.
Другое направление метаболизма триптофана приводит к триптамину и индолилуксусной кислоте:









 СН2 – СН – СООН
СН2 – СН – СООН
NH2
 N
N
H
 D, L – триптофан
D, L – триптофан
 окисление,
окисление,
декарбоксилирование декарбоксилирование





















 CH2–COOH СH2CH2NH2 HO СH2–CH2–NH2
CH2–COOH СH2CH2NH2 HO СH2–CH2–NH2
 окисление
окисление
 | |||||||||||||
 |  |  |  |  |  | ||||||||


 N N N
N N N
H H H
индолилуксусная триптамин серотонин
кислота
Индолилуксусная и индлилпропионовая кислоты являются стимуляторами роста растений, благоприятствующими корнеобразованию при вегетативном размножении. Индолилуксусная кислота получается совместной конденсацией индола с формальдегидом и цианидом калия по механизму электрофильного замещения, а индолилпропионовая кислота синтезируется цианэтилированием индола:















 CH2CN CH2COOH
CH2CN CH2COOH


CH2O; KCN (ОН–)










 1500C;~106Па N –NH3 N
1500C;~106Па N –NH3 N
Н H
 β – индолилацетонитрил β – индолилуксусная кислота
β – индолилацетонитрил β – индолилуксусная кислота
 N
N
















 H CH2CH2CN CH2CH2COOH
H CH2CH2CN CH2CH2COOH
 CH2=СH – CN (ОН–)
CH2=СH – CN (ОН–)


 N –NH3 N
N –NH3 N
120-1300C H H
β – индолилпропиононитрил β – индолилпропионовая кислота
Кислородные производные индола – оксиндол, индоксил, изатин.
Оксиндол существует в кето-форме и образует два ряда производных. Это явление объяснялось таутомерией:






 СН2 СН2
СН2 СН2


 С = О C – OH
С = О C – OH




 N N
N N
H
кетонная форма гидрокси-форма
Возможно, что истинная причина кроется в способности иона, возникающего при отрыве протона, к двойственному реагированию.
Индоксил важен как промежуточный продукт при синтезе индиго, в которое он легко превращается при окислении. Он, по-видимому, способен к таутомерии:


 О OH
О OH






 С C
С C



 СН2 CH
СН2 CH
 | |||||
 |  | ||||

 N N
N N
H H
индоксил
Изатин был получен при окислении индиго хромовой смесью или азотной кислотой. Сейчас его синтезируют из анилина, хлоральгидрата и гидроксиламина. Сначала образуется изонитрозоацетанилид, который затем превращается в изатин.
Изатин (кристаллы красного цвета с темп. пл. 200-2010С) легко размыкает цикл, обратимо превращаясь в изатиновую кислоту.
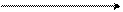






 + СН (ОН)2 + NH2OH CH = NOH
+ СН (ОН)2 + NH2OH CH = NOH
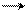

 CCl3 –3HCl; –H2O C = O
CCl3 –3HCl; –H2O C = O
NH2 NH
анилин хлоральгидрат гидроксиламин изонитрозоацетанилид



 O O
O O








 C KOH C
C KOH C
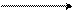
 C = O COOK
C = O COOK

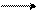 HCl
HCl
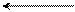
 N NH2
N NH2
H
изатин калиевая соль изатиновой кислоты
Индиго – синий краситель, применявшийся еще в глубокой древности, впервые упоминается Ю. Цезарем в его «Записках о галльской войне». Первоначально его добывали из индигоносных растений (разновидности индигоферы и вайды), где он находился в виде глюкозида, гидролизующегося под влиянием ферментов или минеральной кислоты до глюкозы и индоксила:

 ОС6Н11О5 ОН
ОС6Н11О5 ОН











 С С
С С
 СН H2O СН
СН H2O СН
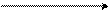
 –C6H12O6
–C6H12O6

 N N
N N
H H
глюкозид индоксила индоксил
Строение индиго было установлено А. Байером в 1870 г., им же впервые осуществлен синтез индиго. Технические способы синтеза были предложены учеником А. Байера – К. Гейманом. Исходными продуктами в них служат анилин или антраниловая и монохлоруксусная кислоты.
Конденсация анилина с натриевой солью хлоруксусной кислоты приводит к фенилглицину, который циклизуется при нагревании со щелочными агентами (гидроксидом калия, смесью гидроксида калия и гидроксида натрия или амидом натрия). Эта операция является наиболее ответственной. Далее индоксил окисляется кислородом воздуха в индиго.
Конденсация антраниловой кислоты с натриевой солью хлоруксусной кислоты дает фенилглицин-о-карбоновую кислоту, которая циклизуется в α-индоксилкарбоновую кислоту. Ее декарбоксилирование приводит к индоксилу, а затем при окислении образуется индиго:




 NaO O O
NaO O O





 C C
C C

 + OH + CH2 – COONa
+ OH + CH2 – COONa


 CH2 Cl
CH2 Cl
NH2 Cl NH2
анилин натриевая соль антраниловая кислота
 хлоруксусной кислоты
хлоруксусной кислоты

–HCl – NaCl




 HO O O
HO O O







 C C
C C
OH


 CH2 CH2 – COOH
CH2 CH2 – COOH

 N N
N N
H H
фенилглицин фенилглицин – о-карбоновая кислота
 | |||
 | |||
–Н2О 1) КОН; 3000С –Н2О NaOH

 2) КОН + NaOH O
2) КОН + NaOH O




 3) NaNH2; 150-2000C C
3) NaNH2; 150-2000C C
 CH – COOH
CH – COOH
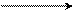
 N
N
H
α-индоксилкарбоновая кислота
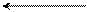


 О
О




 С
С
CH2 –CO2
 N
N
H
индоксил

O2 (воздух)







 O H
O H



 C N
C N




 C C
C C



 N C
N C
 H O
H O
индиго
Индиго имеет транс-строение, при котором пространственно сближенные карбонильные группы и атомы водорода имино-групп образуют внутримолекулярные водородные связи. Подобное строение индиго объясняет его высокую прочность, стойкость к свету.
Индиго – родоначальник большой группы индигоидных красителей. Это темно-синий порошок (темп. пл. 390-3920С), легко возгоняющийся с образованием пурпурно-красных паров. Он нерастворим в воде и в обычных органических растворителях, хорошо растворяется в кипящем анилине и нитробензоле. При восстановлении гидросульфитом натрия (Na2S2O3) получается бесцветное соединение – лейкоиндиго (белое индиго, от греч. «лейкос» - белый):





 О Н OH H
О Н OH H













 С N C N
С N C N









 C C [H] C C
C C [H] C C








 N C [О] N C
N C [О] N C
H O H OH
синее индиго белое индиго
Лейкоиндиго содержит гидроксильные группы фенольного характера, поэтому легко растворяется в щелочах. На воздухе щелочной раствор лейкоиндиго легко окисляется, снова превращаясь в синее индиго.
Краситель индиго был известен в Древнем Египте за 2000 лет до н. э. Его структура показывает еще одну особенность длинноволнового поглощения света. Окисленная и восстановленная формы индиго резко различаются по способности поглощать свет. Окисленная форма имеет интенсивно голубой цвет и поглощает свет при 606 нм, а восстановленная форма (лейко-форма) бесцветна.
На этом принципе основано крашение индиго. При крашении ткань или пряжу погружают в щелочной раствор лейкоиндиго, называемый индиговым кубом (способностью выбираться целлюлозой обладает кислая соль лейкоиндиго, В. Г. Абозин), затем вынимают и оставляют на воздухе. Лейкоиндиго на ткани или пряже окисляется и превращается в синее индиго, окрашивающее материал в глубокий чистый синий цвет. Краситель неустойчив к трению, что и требуется при крашении джинсов.
Индиго применяют для крашения хлопка, в ситцепечатании, а также для крашения шерсти. Исследования по установлению строения индиго и разработке методов его синтеза являются одной из ярких страниц в развитии органической химии второй половины XIX в.
Из других природных красителей, известных с глубокой древности, отмечают 6,6΄-диброминдиго и ализарин. 6,6΄-Диброминдиго получали из средиземноморских моллюсков и применяли при крашении тканей в пурпурный цвет для знатных вельмож.





 О Н O OH
О Н O OH










 С N Br OH
С N Br OH








 C C
C C










 Br N C
Br N C
H O O
6,6΄-диброминдиго ализарин
Ализарин добывали из корней марены и применяли для крашения тканей в алый цвет, предварительно обрабатывая ткань солями алюминия.
В настоящее время все эти природные красители получают синтетически.
Соединение, в котором пиррольный цикл конденсирован с двумя бензольными кольцами, называется карбазолом. Карбазол входит в состав антраценовой фракции каменноугольной смолы. Это бесцветное кристаллическое соединение (темп. пл. 245-2470С). Его используют для получения ценных сернистых кубовых красителей и инсектицидов, применяемых для борьбы с вредителями виноградников. Технический интерес представляет N-винилкарбазол, получаемый присоединением ацетилена к карбазолу:



 5 4
5 4





 6 3 HC ≡CH
6 3 HC ≡CH
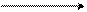 7
7





 8 N9 2 N
8 N9 2 N
H 1
CH=CH2
карбазол N-винилкарбазол
N-Винилкарбазол при полимеризации образует поливинилкарбазол, известный под названием полектрона, обладающий исключительно высокой диэлектрической постоянной. Винилкарбазольные полимеры применяют в качестве покровных материалов, для пропитывания бумаги и т. д. N-Винилкарбазол физиологически активен: попадая на кожу, он вызывает дерматит (воспаление кожи).
Дата добавления: 2017-01-16; просмотров: 2178;











