Кислотно-основные свойства ароматических аминов
Ароматические амины имеют менее выраженный основной характер, чем жирные амины. Кдиссоциации метиламина (СН3NH2) = 4,4·10–5, а Кдиссоциации анилина (С6Н5NH2) = 3,8·10–10.
 C6H5 – NH2 + H2O C6H5 – NH3+ + HO–
C6H5 – NH2 + H2O C6H5 – NH3+ + HO–
анилин фениламмоний
(анилиний-катион)
Уменьшение основности анилина по сравнению с алифатическими аминами объясняется взаимодействием неподеленной электронной пары у атома азота аминогруппы с π-электронами ароматического кольца. Такое сопряжение снижает способность неподеленной пары электронов азота присоединять протон. К тому же, при солеобразовании теряется сопряжение заместителя с кольцом по причине выхода аминогруппы из плоскости кольца, что энергетически не выгодно.
 | |||
 | |||

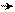
 ׃ NH2 NH3+
׃ NH2 NH3+
 |  |

 + H+
+ H+


сопряжение р-электронов атома тетраэдрическая гибридизация атома
азота с π-электронами кольца присутствует азота аммонийной группы выводит ее из одной
(пирамидальная гибридизация атома азота- плоскости с кольцом, сопряжение заместителя
направленность валентностей тетраэдрическая) с π-электронами кольца отсутствует
В ряду аминов: анилин, аммиак, метиламин основные свойства увеличиваются по причине увеличения отрицательного заряда на атоме азота:
 ׃NH2
׃NH2
 •• δ– ••
•• δ– ••

 < H – N – H < CH3 NH2
< H – N – H < CH3 NH2
H
анилин аммиак метиламин
(р-π-сопряжение IH = 0 +I (CH3)
атома азота с кольцом) отрицательный заряд отрицательный заряд на атоме
уменьшение отрицательного на атоме азота не изменяется азота увеличивается
заряда на атоме азота
Присутствие электронодонорных групп в ядре увеличивает основность аминов, а присутствие электроноакцепторных групп уменьшает основность аминов. Например, константа основности орто-оксианилина равна 3·10–6 , а константы основности для орто-, мета- и пара-нитроанилинов соответственно равны 1·10–14, 4·10–12 и 1·10–13.
С другой стороны, алкилирование аминогруппы увеличивает основность ароматических аминов по причине выхода из копланарности алкилированных аминогрупп (стерический фактор):












 δ–•• δ–•• δ–
δ–•• δ–•• δ–
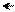
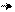






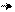



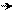 ׃NH2 СН3 NH СН3 N CH3
׃NH2 СН3 NH СН3 N CH3


 < <
< <
анилин N-метиланилин N,N-диметиланилин
Ка=3,8·10–10 Ка=7,1·10–10 Ка=1,1·10–9
Введение второго ароматического кольца в молекулу сильно уменьшает основные свойства амина, а введение третьего ароматического кольца практически лишает основных свойств амина. Это объясняется увеличением сопряжения р-электронов азота аминогруппы с π-электронами бензольных колец («рассеивание эффекта»), в результате чего на атоме азота практически не остается свободной электронной плотности (в случае трифениламина):
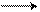
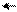
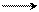
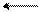



 •• ••
•• ••






 NH > N
NH > N
дифениламин трифениламин
Ка=7,6·10–14
Основность амина проявляется в способности к реакциям с протоном (реакция солеобразования):
 HCl NH3+
HCl NH3+


 ׃NH2
׃NH2

 Cl–
Cl–
 |  |
хлористый анилиний
(хлорид фениламмония)
 |  |

 анилин H2SO4 NH3+ C6H5NH2 NH3+
анилин H2SO4 NH3+ C6H5NH2 NH3+
 |  | ||||||
 |  | ||||||

 HSO4– SO42–
HSO4– SO42–
2

 гидросульфат анилиний
гидросульфат анилиний
(гидросульфат фениламмония) сернокислый анилин
Солянокислая соль анилина хорошо растворяется в воде, а сернокислая – плохо.
Дата добавления: 2017-01-16; просмотров: 3774;











