Гидролиз галогенопроизводных аренов
При гидролизе бензотрихлорида образуется хлористый бензоил, который при последующем взаимодействии с водой дает бензойную кислоту:
H2O H2O
 C6H5 – CСl3 C6H5 – CO-Cl C6H5 – COOH
C6H5 – CСl3 C6H5 – CO-Cl C6H5 – COOH
–2HCl –HCl
бензотрихлорид хлористый бензоил бензойная кислота
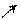 Электронное строение бензойной кислоты
Электронное строение бензойной кислоты

 Оδ–
Оδ–

 Сδ+ Карбоксильная группа является электроноакцепторным
Сδ+ Карбоксильная группа является электроноакцепторным
 О Н δ+ заместителем, который обедняет электронной плотностью
О Н δ+ заместителем, который обедняет электронной плотностью

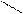
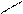
 δ + ••δ+ бензольное кольцо по отрицательному индуктивному
δ + ••δ+ бензольное кольцо по отрицательному индуктивному
δ– δ– эффекту и по отрицательному мезомерному эффекту
δ+ в виде (π-π)-сопряжения.
– I, – M (π – π)
В результате этих эффектов в орто- и пара- положениях кольца по отношению к карбоксильной группе возникают частично положительные заряды, а в мета-положении локализуются частично отрицательные заряды.
Отсюда следует, что реакции замещения электрофильного характера будут идти в м-положение бензольного кольца относительно карбоксильной группы, а нуклеофильные реагенты будут атаковать о- и п-положения кольца, то есть карбоксильная группа является ориентантом 2-го рода в реакциях замещения электрофильного характера и будет затруднять их течение.
Однако, электроноакцепторные свойства карбоксильной группы выражены слабее, чем у нитро-, нитрильной, альдегидной, кетонной и сульфо-групп. Это объясняется тем, что в карбоксиле существует внутреннее сопряжение электрофильного карбонильного остатка с электронодонорной гидроксильной группой в виде (р-π)-сопряжения. В анионе кислоты бензольное ядро стабилизировано слабее, чем в недиссоциированной кислоте. Отрицательный заряд кислорода подвижнее, чем неподеленная пара электронов, поэтому карбоксилат-анион имеет большее (р-π)-сопряжение, чем карбоксильная группа, отсюда, и влияние карбоксилат-аниона на бензольное ядро будет в меньшей степени, чем карбоксильной группы:
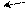
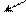

 ••
••
δ 




 – О ОН δ
– О ОН δ 




 – О О–
– О О–

 С С
С С
 |  |
 δ
δ 
 + δ
+ δ 
 + δ
+ δ 
 +1 δ
+1 δ 
 +1 δ+ > δ+1;
+1 δ+ > δ+1;
– Н+ Ка = 6,5 ·10 –5
δ+δ+1
бензойная кислота бензоат-анион
Константы кислотности ароматических кислот возрастают при введении в ароматическое ядро электроноакцепторных групп, ослабляющих связь атома водорода с атомом кислорода в НО-группе. Например, п-нитробензойная кислота имеет константу диссоциации Ка = 42 ·10 –5. Электронодонорные группы понижают подвижность атома водорода в НО-группе, например, п-аминобензойная кислота имеет Ка = 1,2 ·10 –5.
Дата добавления: 2017-01-16; просмотров: 2682;











