Гидролиз солей. Различные случаи гидролиза. Степень и константа гидролиза.
Гидролиз соли – это обменное взаимодействие ионов соли с молекулами воды, приводящее к увеличению кислотности или щелочности раствора и образованию слабодиссоциируемых соединений.
Различают четыре случая взаимодействия соли и воды.
1. Соли, образуемые сильной кислотой и слабым основанием.
Соли этого типа при растворении в воде образуют кислый раствор. Примером может служить хлорид аммония NH4Cl. Уравнение реакции гидролиза данной соли имеет вид
NH4Cl + H2O 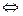 NH4OH + HCl .
NH4OH + HCl .
В ионной форме уравнение реакции гидролиза имеет вид
NH4+ + H2O 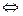 NH4OH + H+.
NH4OH + H+.
Вследствие связывания ионов ОН- ионами аммония в слабодиссоциирующие молекулы NH4OH, в растворе появляется избыток водородных ионов и раствор становится кислым.
2. Соль образована слабой кислотой и сильным основанием.
Соли этого типа при растворении в воде образуют щелочной раствор. При гидролизе соли, образованной слабой кислотой и сильным основанием, образуется слабая кислота и избыток ионов гидроксила ОН-. Примером может служить гидролиз цианида калия, уравнение реакции имеет вид
KCN + H2O 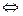 HCN + KOH
HCN + KOH
или в ионной форме
CN- + H2O 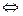 HCN + OH-.
HCN + OH-.
3. Соли, образуемые слабыми кислотами и слабыми основаниями. Данные соли почти полностью гидролизуются. Реакция гидролиза таких солей практически необратима. В качестве примера возьмем ацетат аммония CH3COONH4. Уравнение реакции гидролиза данной соли имеет вид
CH3COONH4 + H2O 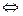 CH3COOH + NH4OH
CH3COOH + NH4OH
или в ионной форме
CH3COO- + HN4+ + H2O 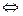 CH3COOH + NH4OH.
CH3COOH + NH4OH.
При растворении в воде ион аммония реагирует как кислота, а ацетат-ион как основание. Поэтому водный раствор данной соли может быть слабокислым, слабощелочным или нейтральным в зависимости от концентрации ионов Н+, ОН-, образуемых в результате реакции катионов и анионов соли с водой. Это зависит от соотношения между константами диссоциации катиона и аниона.
4. Соль образована сильным основанием и сильной кислотой. К этой группе относятся такие соли как KCl, NaCl, NaNO3. Подобные соли гидролизу не подвергаются и растворы их остаются нейтральными. Например,
NaCl + H2O 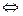 NaOH + HCl.
NaOH + HCl.
Таким образом, можно утверждать, что в рассмотренных случаях гидролизу подвергаются не всё количество, находящейся в растворе соли, а только часть её. При гидролизе устанавливается равновесием между солью и образующими её кислотой и основанием. Доля вещества, подвергающаяся гидролизу, называется степенью гидролиза. Степень гидролиза зависит от константы равновесия, температуры и концентрации соли.
Рассмотрим общее уравнение гидролиза:
MA + H2O 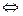 HA+MOH (14),
HA+MOH (14),
где НА – кислота, МОН – основание, МА – соль.
Этому равновесию соответствует константа
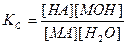 (15).
(15).
Так как [Н2О]=const, то можно ввести другую константу, равную КС ∙[H2O]. Если её обозначить через KГ, то
KГ = КС ∙[H2O].
Из выражения (15) следует, что
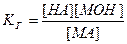 (16).
(16).
Она называется константой гидролиза соли, KГ характеризует способность соли подвергаться гидролизу. Чем больше KГ , тем в большей степени протекает гидролиз.
Можно показать, что для случая соли, образованной слабой кислотой и сильным основанием
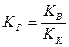 (17).
(17).
Из данного выражения можно сделать следующий вывод:
константа гидролиза KГ тем больше, чем меньше константа кислотности кислоты KК, то есть, чем слабее кислота, тем в большей степени подвергается гидролизу ее соли.
Для соли, образованной слабым основанием и сильной кислотой
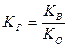 (18),
(18),
где KО – константа основности основания.
Из данного выражения можно сделать вывод:
чем слабее основание, тем в большей степени подвергается гидролизу, образованные им соли.
Для солей, образованных слабой кислотой и слабым основанием:
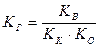 (19),
(19),
где КК, КО – константы гидролиза кислоты и основания.
Рассмотрим гидролиз солей образованных слабой многоосновной кислотой или слабым основанием многоосновного металла. Гидролиз таких солей происходит ступенчато.
Например, гидролиз карбоната натрия
1 ступень гидролиза:
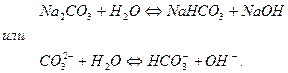
Образовавшаяся кислая соль подвергается дальше гидролизу (2 ступень гидролиза).
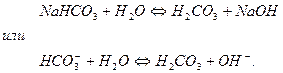
Константа гидролиза по первой ступени 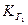 связана со второй константой диссоциации кислоты, а константа гидролиза по 2-й ступени
связана со второй константой диссоциации кислоты, а константа гидролиза по 2-й ступени 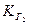 – с первой константой диссоциации кислоты:
– с первой константой диссоциации кислоты:
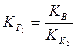
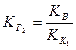 .
.
Так как 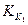 >
> 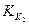 , то
, то 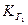 >
> 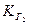 .
.
Из-за этого гидролиз по первой ступени всегда протекает в большей степени, чем по второй.
Гидролиз солей, образованных слабым основанием многовалентного металла, рассмотрим на примере гидролиза хлорида меди (II). Уравнение гидролиза данной соли имеет вид
1-я ступень 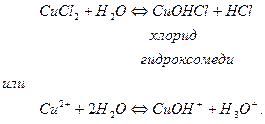
2-я ступень (протекает в очень малой степени).
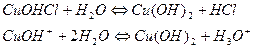
Как видно из (19), особенно глубоко протекает гидролиз солей, образованных слабой кислотой и слабым основанием. Реакция растворов солей, образованных слабой кислотой и слабым основанием, зависит от состояния констант протолиза кислоты и основания. Если 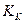 >
> 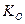 , то раствор будет иметь слабокислую реакцию, если
, то раствор будет иметь слабокислую реакцию, если 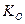 >
> 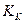 , то раствор будет иметь слабощелочную реакцию.
, то раствор будет иметь слабощелочную реакцию.
Дата добавления: 2017-02-13; просмотров: 3371;











