В) Межмолекулярные реакции циклоприсоединения (реакция Дильса-Альдера) или реакция диенового синтеза
Реакции диенового синтеза были открыты в 1928 г. и названы в честь ученых, которые открыли и изучили эти реакции, реакциями Дильса – Альдера.
Реакция диенового синтеза заключается во взаимодействии соединений, содержащих сопряженную систему двойных связей, с соединениями, имеющими двойную или тройную связь, активированную электроноакцепторными группами. Этой реакцией получают шестичленные и более циклы.
Диеновые компоненты называют диенами, а этиленовые или соединения с активированной двойной или тройной связью – диенофилами. В качестве диенов применяют бутадиен – 1,3 и его гомологи, циклопентадиен и другие, а диенофилами могут быть малеиновый ангидрид, акрилонитрил, акриловый альдегид, нитроэтилен и другие.
Реакция диенового синтеза протекает по синхронному циклическому механизму. Она характеризуется согласованным смещением электронных плотностей, которое, раз начавшись, протекает спонтанно и сопровождается одновременным разрывом кратных π-связей и образованием простых σ-связей.
Например, взаимодействие бутадиена – 1,3 и акрилового альдегида:
δ+





 СН2 2СН2 σ-связь
СН2 2СН2 σ-связь





 СН + СН – СН = Оδ – 3СН 1СН – СН = О
СН + СН – СН = Оδ – 3СН 1СН – СН = О

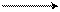



 СН δ+СН2 4 СН 6СН2
СН δ+СН2 4 СН 6СН2
СН2 5СН2 σ-связь
δ–
диен диенофил аддукт
(бутадиен – 1,3) (акриловый альдегид) (тетрагидробензойный альдегид)
(циклогексен-3-аль)
В диенофиле π – связь (С – С) очень активна за счет сопряженной с ней С = О группой, поэтому π – связь (С – С) в диенофиле легко разрывается и взаимодействует с диеном. В результате образуются простые σ-связи.
В другом примере взаимодействия бутадиена – 1,3 и малеинового ангидрида образуется бициклический аддукт реакции:

 О
О








 СН2 СН – С СН2 О
СН2 СН – С СН2 О




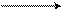

 СН + О СН СН – С
СН + О СН СН – С




 СН СН – С О
СН СН – С О



 СН2 О СН СН – С
СН2 О СН СН – С
СН2 О
диен диенофил аддукт
(бутадиен-1,3) (малеиновый ангидрид)
При взаимодействии несимметричных диенов (одно- и двузамещенных) с диенофилами могут образовываться в каждом случае по два структурных изомера. Например, изопрен с этиловым эфиром метакриловой кислоты дает аддукты с различным расположением заместителей:
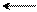



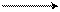


 СН2 СН3 СН2
СН2 СН3 СН2
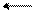
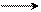






 СН3 СН2 С – СООС2Н5 С СН2
СН3 СН2 С – СООС2Н5 С СН2
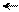
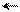



 С + СН3 СН С – СООС2Н5
С + СН3 СН С – СООС2Н5


 СН диенофил СН2 СН3
СН диенофил СН2 СН3
 СН2 СН3 (I)-изомер
СН2 СН3 (I)-изомер





 диен С – СООС2Н5 СН3 СН2 СН3
диен С – СООС2Н5 СН3 СН2 СН3


 (изопрен) СН2 С С – СООС2Н5
(изопрен) СН2 С С – СООС2Н5

 диенофил СН СН2
диенофил СН СН2
(этиловый эфир метакриловой кислоты) СН2
(II)-изомер
Промежуточной стадией является образование молекулярного комплекса, который возникает в результате жесткого взаимного ориентирования компонентов и стабилизируется затем путем перераспределения связей в конечный продукт реакции. Этот промежуточный комплекс (π) снижает энергию активации реакции.
Структурная направленность диенового синтеза определяется сложным взаимодействием электронных и стерических эффектов заместителей в диене и диенофиле.
Исследуя стереохимию реакции циклических диенов, например, циклопентадиена, с диенофилами, содержащими группы с кратными связями, например, малеиновый ангидрид, легко установить, что из двух возможных промежуточных молекулярных комплексов, имеющих эндо- и экзо-конфигурации, образуется исключительно эндо-комплекс. В нем компоненты максимально сближены, что обеспечивает взаимодействие их π-электронных облаков.
 |  |  |











 О О
О О









 О О
О О



 О О О
О О О

 О
О


О
промежуточный промежуточный эндо – аддукт
экзо – комплекс эндо – комплекс
На основе представления об уровнях граничных молекулярных орбиталей показано, что реакция диенового синтеза протекает в результате взаимодействия высшей занятой молекулярной орбитали диена (ВЗО) с низшей свободной молекулярной орбиталью диенофила (НСО) (эта стадия является определяющей) и в результате противоположного переноса электронов с ВЗО диенофила на НСО диена:



 НСО НСО В классическом варианте реакции
НСО НСО В классическом варианте реакции
диенового 
 синтеза диен является
синтеза диен является






 ВЗО ВЗО нуклеофилом, а диенофил
ВЗО ВЗО нуклеофилом, а диенофил
диен диенофил электрофилом.Но может быть и
обратная зависимость.
Примером реакции диенового синтеза (реакции Дильса – Альдера) является и взаимодействие 1,4-динитроциклогексадиена-1,3 (фиксированный цис-диен) с винилбензолом (стиролом):


 7 8
7 8


 NO2 NO2 O2N NO2
NO2 NO2 O2N NO2
















 2 1 CH2 ксилол,1000 2 7 1 6 1 4
2 1 CH2 ксилол,1000 2 7 1 6 1 4

 3 + CH – C6H5 3 8 5 C6H5
3 + CH – C6H5 3 8 5 C6H5
 4 стирол 4 С6Н5
4 стирол 4 С6Н5


 NO2 NO2 2 3 6 5
NO2 NO2 2 3 6 5
1,4-динитроциклогексадиен-1,3 1,4-динитро-5-фенилбицикло[2.2.2]октен-2
Дата добавления: 2017-01-16; просмотров: 2482;











