Лекция 12 Реальные газы, жидкости и твердые тела
12.1 Уравнение состояния реальных газов
12.2 Внутренняя энергия реального газа
12.3 Свойства жидкостей и твердых тел
12.4 Фазовые переходы первого и второго рода
12.1 Уравнение состояния реальных газов
При рассмотрении идеальных газов предполагалось, что молекулы подобны материальным точкам, собственный объем молекул не принимался во внимание, не учитывались силы межмолекулярного взаимодействия. Такие предположения позволили построить молекулярно-кинетическую теорию, рассмотреть явления переноса и др.
Наличие межмолекулярных сил взаимодействия и конечные размеры молекул являются основными отличиями реальных газов от идеальных. Эти отличия непрерывно возрастают с увеличением давления.
Учет конечных размеров молекул и сил притяжения между ними позволяет получить уравнение состояния реальных газов из уравнений Клапейрона—Менделеева путем внесения поправки a/V2 к давлению и поправки b к объему:
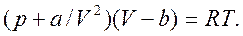 (12.1)
(12.1)
Это уравнение называется уравнением Ван-дер-Ваальса. Записано оно для 1 моля газа. Поправка b, внесенная к объему, учитывает объем, занимаемый молекулами реального газа, и мертвое пространство, т. е. объем зазоров между молекулами при их плотной упаковке. Поправка a/V2 к давлению учитывает силы взаимодействия между молекулами реальных газов. Эта поправка представляет собой внутреннее давление, возникающее из-за взаимного притяжения между молекулами. Воздействие молекул друг на друга осуществляется в пределах радиуса молекулярного действия. Константы а и b могут быть определены для каждого газа опытным путем по критическим параметрам.
Учитывая большое значение уравнения Ван-дер-Ваальса, остановимся на его характеристике более подробно. Рассмотрим графическое изображение изотерм Ван-дер-Ваальса на диаграмме р, V (рисунок 12.1).
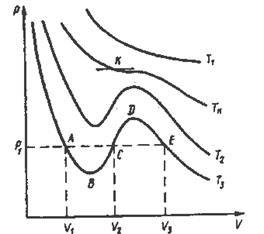
Рисунок 12.1 – Изотермы Ван-дер-Ваальса
Как видно из диаграммы, вид изотерм зависит от температуры, при которой протекает изотермический процесс. На изотерме Т3 < Т2 < Тк одному значению давления р соответствуют три значения объема: V1, V2, V3. Для изотермы Тк характерно наличие точки перегиба К, изотерма Т1 > Тк имеет вид плавной кривой, совпадающей с изотермой для идеального газа.
Уравнение Ван-дер-Ваальса — уравнение третьей степени относительно объема V, поэтому оно имеет или три вещественных корня (при Т < Тк,) или один вещественный и два комплексно-сопряженных, не имеющих физического смысла (при Т > Тк ) корня, т. е. при температуре ниже Тк одному значению давления соответствуют три значения объема, при температуре выше Тк одному значению давления соответствует одно значение объема. Отсюда следует, что при температуре выше Тк вещество находится в однофазном газообразном состоянии, а при температуре ниже Тк вещество одновременно находится в двух фазовых состояниях.
Дата добавления: 2017-01-08; просмотров: 2275;











