Внутренняя энергия реального газа
В отличие от идеальных газов, где внутренняя энергия представляет собой лишь кинетическую энергию движения молекул, зависящую от температуры и не зависящую от занимаемого газом объема, поскольку в газе отсутствует межмолекулярное взаимодействие, в реальных газах межмолекулярные взаимодействия играют существенную роль. Поэтому внутренняя энергия реального газа определяется суммой потенциальной энергии взаимодействия молекул и кинетической энергии их движения.
Так как потенциальная энергия взаимодействия молекул зависит от их взаимного расположения, то она должна изменяться при изменении объема газа. Потенциальную энергию взаимодействия молекул одного моля газа можно вычислить по формуле
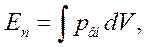 (12.2)
(12.2)
где рвн = - а/V2  — добавочное внутреннее давление, входящее в уравнение Ван-дер-Ваальса. Подставив значение рвнв уравнение (12.2), имеем
— добавочное внутреннее давление, входящее в уравнение Ван-дер-Ваальса. Подставив значение рвнв уравнение (12.2), имеем
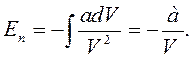 (12.3)
(12.3)
Эта энергия имеет отрицательный знак, так как молекулярные силы, создающие внутреннее давление, являются силами притяжения.
Используя закон Джоуля, можно вычислить внутреннюю энергию одного моля реального газа:
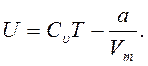 (12.4)
(12.4)
Внутренняя энергия v молей газа определяется по формуле
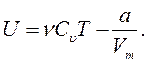 (12.5)
(12.5)
Внутренняя энергия реального газа зависит как от температуры, так и от объема.
Рассмотрим расширение реального газа в пустоту. В этом случае внешнее давление равно нулю, поэтому газ не совершает работу против внешних сил. Но в реальном газе действуют силы межмолекулярного взаимодействия, и при расширении газа совершается работа по преодолению этих сил за счет внутренней энергии газа. Вследствие этого температура реального газа при расширении в пустоту должна понижаться.
Однако это не совсем так, в некоторых случаях может происходить и повышение температуры. Реальный газ при расширении охлаждается в том случае, когда преобладает действие сил притяжения между молекулами газа. Тогда молекулы газа совершают работу против сил притяжения за счет своей кинетической энергии, вследствие чего кинетическая энергия уменьшается, т. е. температура понижается. Если преобладает действие сил отталкивания между молекулами газа, то при расширении скорость молекул не уменьшается, а увеличивается, т.е. температура возрастает.
Следовательно, в зависимости от того, что преобладает — силы притяжения между молекулами или силы отталкивания, — может получиться при расширении газа в пустоту или нагревание газа, или охлаждение.
Дата добавления: 2017-01-08; просмотров: 4277;











