Распределение молекул по скоростям и энергиям
Распределение Максвелла.При изучении газов принята основная модель — модель идеального газа как большого коллектива невзаимодействующих частиц, непрерывно участвующих в беспорядочном тепловом движении. К этому коллективу частиц применим статистический метод, базирующийся на математической теории вероятностей, на понятиях о средних, среднеквадратичных и наиболее вероятных параметрах, характеризующих поведение частиц в коллективе.
Рассмотрим распределение Максвелла или распределение молекул по скоростям.
Скорости молекул газа имеют различные значения и направления,
причем как величина, так и направление скорости каждой отдельной молекулы изменяются в результате соударений, поэтому нельзя определить
число молекул, обладающих точно заданной скоростью в данный момент времени, но можно подсчитать число молекул, скорости которых лежат в интервале от 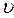 до
до 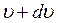 .
.
При этом предполагается, что в газе не существует молекул, имеющие в точности одинаковые скорости, и число молекул dN, скорость которых лежит в узком интервале между 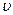 и
и 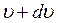 пропорционально общему числу молекул N, ширине интервала
пропорционально общему числу молекул N, ширине интервала 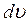 и зависит от скорости
и зависит от скорости 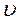 . Такаятеоретическая зависимость была установлена Максвеллом на основании теории вероятностей:
. Такаятеоретическая зависимость была установлена Максвеллом на основании теории вероятностей:
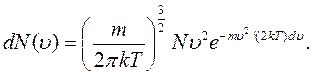 (11.11)
(11.11)
Функцию
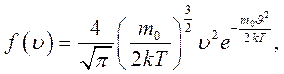 (12.12)
(12.12)
показывающую относительное число молекул, скорость которых лежит в интервале скоростей 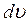 , называют функцией распределения молекул газа по скоростям.Графически эта функция представлена на рисунке 11.1.
, называют функцией распределения молекул газа по скоростям.Графически эта функция представлена на рисунке 11.1.
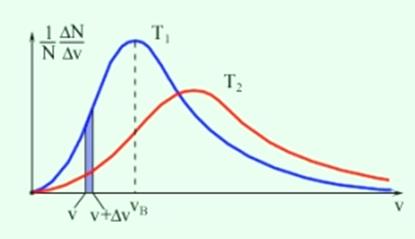
Рисунок 11.1 – Вид распределения Максвелла для различных температур
Заштрихованная область соответствует относительному числу молекул газа, скорости которых лежат в интервале от 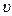 до
до 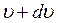 . Максимум кривой распределения соответствует наиболее вероятной скорости молекул
. Максимум кривой распределения соответствует наиболее вероятной скорости молекул 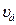 , которую можно найти, исследовав на максимум функцию f(
, которую можно найти, исследовав на максимум функцию f( 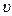 ). Беря производную от (12.2) по скорости и приравнивая ее нулю, легко получить выражение для наиболее вероятной скорости молекул.:
). Беря производную от (12.2) по скорости и приравнивая ее нулю, легко получить выражение для наиболее вероятной скорости молекул.:
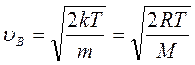 (11.13)
(11.13)
Вид функции распределения f( 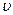 )зависит от рода газа (массы молекул) и температуры Т. Давление и объем газа на распределение молекул по скоростям не влияют.
)зависит от рода газа (массы молекул) и температуры Т. Давление и объем газа на распределение молекул по скоростям не влияют.
При повышении температуры (Т2 > Т1) 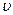 В возрастает, поэтому максимумы кривой распределения молекул по скоростям сдвигаются в сторону больших скоростей (рис. 12.1); следовательно, с ростом температуры возрастает относительное число молекул, обладающих большой скоростью.
В возрастает, поэтому максимумы кривой распределения молекул по скоростям сдвигаются в сторону больших скоростей (рис. 12.1); следовательно, с ростом температуры возрастает относительное число молекул, обладающих большой скоростью.
Кроме наиболее вероятной скорости движение молекул газа характеризует средняя арифметическая скорость:
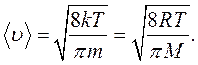 . (11.14)
. (11.14)
Средняя квадратичная скорость определяется как квадратный корень из среднего квадрата скорости и связана со средней кинетической энергией поступательного движения молекул. Чтобы найти её с помощью распределения Максвелла, нужно определить отношение суммы квадратов скоростей молекул, содержащихся в единице объёма, к числу молекул в этом объёме:
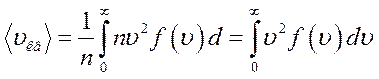
Для идеального газа, находящегося в состоянии термодинамического равновесия при температуре Т, она равна :
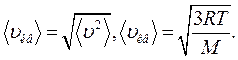 (11.15)
(11.15)
Если все молекулы одинаковы по массе, то
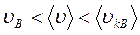 .
.
Используя распределение молекул идеального газа по скоростям
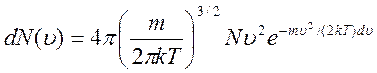
найдем распределение молекул газа по энергиям.
Молекулы идеального газа обладают кинетической энергией Е=1/2m 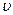 2, откуда следует, что
2, откуда следует, что

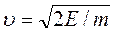 и
и 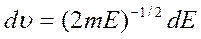
Переходя от переменной 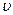 к переменной Е, получаем
к переменной Е, получаем
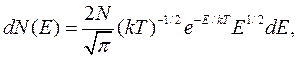 (11.16)
(11.16)
где dN(E) — число молекул, имеющих кинетическую энергию, заключенную в интервале от Е до Е + dE.
Функция распределения молекул по энергиям имеет вид
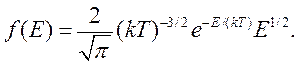 (11.17)
(11.17)
Средняя кинетическая энергия молекулы идеального газа (Е) определяется интегралом:
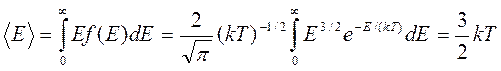 . (11.18)
. (11.18)
Закон распределения Больцмана. При рассмотрении закона распределения Максвелла предполагалось, что молекулы равномерно распределяются по всему объему сосуда, что справедливо, если объем сосуда небольшой.
Для больших объемов равномерность распределения молекул по объему нарушается из-за действия силы тяжести, вследствие чего плотность, а следовательно, и число молекул в единице объема будут неодинаковыми. Рассмотрим молекулы газа, находящегося в поле тяготения Земли.
Выясним зависимость давления атмосферы от высоты над поверхностью Земли. Допустим, на поверхности Земли (h = 0) давление атмосферы р0. На высоте h оно равно р. При увеличении высоты на dh давление уменьшится на dр:
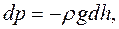
где р — плотность воздуха на данной высоте, р = тп0, где m — масса молекулы, n0 — концентрация молекул].
Используя соотношение р = п0кТ, получаем
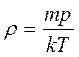
тогда
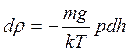 (11.19)
(11.19)
Полагая, что на некоторой высоте h T= const, g = const, разделяя переменные, интегрируем выражение (11.19):
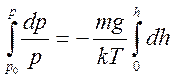
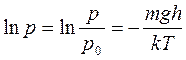
Получаем
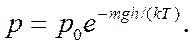 (11.20)
(11.20)
Это, так называемая барометрическая формула. Барометрическая формула показывает зависимость давления газа от высоты над поверхностью Земли. Если учесть, что концентрация молекул воздуха в атмосфере определяет давление, то формулу (11.20) можно записать в виде
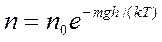 (11.21)
(11.21)
Из формулы (11.21) следует, что с понижением температуры число частиц на высоте, отличной от нуля, убывает и при Т = О К обращается в нуль, т. е. при О К все молекулы расположились бы на земной поверхности.
Так как потенциальная энергия молекул на различной высоте различна и на высоте h определяется по формуле Е„ = mgh, то
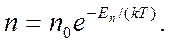 (11.22)
(11.22)
Выражение (11.22) представляет собой закон Больцмана, показывающий распределение участвующих в тепловом движении молекул в потенциальном поле сил, в частности в поле силы тяжести.
Закон Больцмана является универсальным, он справедлив для любых частиц, находящихся в потенциальном поле сил. Он выражает условие равновесия между тепловым движением, стремящимся к максимальному рассеянию частиц, и действием внешних сил — сил тяжести, стремящихся к максимальному уплотнению частиц вблизи земной поверхности.
Экспериментальные подтверждения справедливости распределения Больцмана были получены при определении постоянной Авогадро.
Постоянная Авогадро была определена двумя независимыми способами. Первый способ основан на применении барометрической формулы к эмульсиям и суспензиям, находящимся в равновесном состоянии. Другой способ был предложен Ж. Перреном и основан на наблюдении броуновского движения. Эти два способа дали одинаковые результаты. Постоянная Авогадро, т. е. число молекул в 1 моль вещества, равна 6,023 1023 моль-1.
Дата добавления: 2017-01-08; просмотров: 8848;











