Уравнение состояния идеального и реального газа.
Уравнение состояния идеальных газов.аналитическая зависимость между основными параметрами состояния газа (объем, давление и температура). Уравнением состояния идеальных газов называют уравнение Менделеева-Клапейрона или Клапейрона-Менделеева, 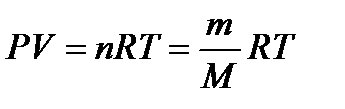
где Р – абсолютное давление, Па; V – объем занимающий газом, м3; n – число киломолей газа; m – масса вещества; М – молекулярная масса; Т – абсолютная температура, К; R – универсальная газовая постоянная, 8314,3 Дж/(кмоль∙К).
Универсальная газовая постоянная – это работа расширения одного моля газа при нагревании на один градус при постоянном давлении. В системе СИ измеряется Дж/(моль*К) и равняется 8,3143.
Уравнение состояния реальных газовДля описания поведения природных газов во время добычи, переработки и транспортировки, при давлениях выше атмосферного, наиболее широко в отрасли используется следующее уравнение:
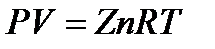
где Z – безразмерный коэффициент сферхсжимаемости газа, который вводится в уравнение состояния идеального газа, для того чтобы учитывать отклонение реального газа от законов идеального.
7. Критические параметры газа: Ткр , Ркр .
Критическим состоянием вещества (газа) является такое состояние, при котором исчезает граница между его газовой и жидкой фазой и свойства этих фаз становятся равными друг другу.
Критические параметры газа.Критической называется такая температура, выше которой, при любом давлении, газ не может быть переведен в жидкое состояние. Давление, необходимое для сжижения газа при критической температуре, называется критическим.Приведенные параметры газа.Приведенными параметрами называют безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (давление, температура, плотность, удельный объем) больше или меньше критических: 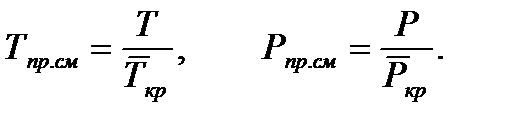
Дата добавления: 2016-12-27; просмотров: 7353;











