Молекулярная адсорбция.
Неэлектролиты и слабые электролиты на поверхности адсобента адсорбируются из растворов в виде молекул. Такой процесс называют молекулярной адсорбцией.
В результате такой адсорбции концентрация растворенного вещества в растворе уменьшается. Адсорбцию определяют по формуле:
А= 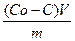 ,
,
где С0 – исходная концентрация адсорбата, моль/л;
С – равновесная концентрация адсорбата, моль/л;
V – объем раствора адсорбата, из которого происходила адсорбция, л;
m – масса адсорбента, г.
Адсорбция зависит от природы и концентрации адсорбата, температуры, природы адсорбента и растворителя, удельной поверхности адсорбента.
Отечественный физикохимик П.А. Ребиндер сформулировал правило выравнивания полярности: на полярных адсорбентах лучше адсорбируются полярные адсорбаты из малополярных растворителей; на неполярных адсорбентах – неполярные адсорбаты из полярных растворителей.
Для системы адсорбат – адсорбент влияние природы растворителя на адсорбцию может быть также сформулировано в виде следующего правила: чем лучше в данном растворителе растворяется данный адсорбат, тем он хуже адсорбируется; тем хуже растворяется – тем лучше из него адсорбируется.
Как известно, адсорбция экзотермична, а поэтому с повышением температуры уменьшается. Однако если растворимость адсорбтива в данном растворителе падает с ростом температуры, то адсорбция из раствора твердым адсорбентом может увеличиваться.
С ростом концентрации раствора адсорбция на границе раздела твердое тело - раствор возрастает до предельного значения. Анализ экспериментально наблюдаемой изотермы аналогичен анализу, приведенному в предыдущем разделе. Для этого используются уравнения Фрейндлиха и Ленгмюра
При адсорбции ПАВ на границе раздела твердое тело – раствор, так же как и на границе раствор – газ, наблюдается различная ориентация молекул адсорбата. В системе полярный адсорбент – неполярный растворитель молекулы адсорбата обращены полярной частью («головой») к поверхности адсорбента, а неполярная их часть («хвост») погружена в растворитель (рис.27)
В качестве примера можно привести поведение дифильного вещества по отношению к неполярному адсорбенту - активированному углю в полярной среде - воде. В таких условиях молекулы дифильной природы будут адсорбироваться на поверхности угля, ориентируясь по отношению к нему своими гидрофобными участками. Напротив, те же молекулы в неполярном растворителе, бензоле, адсорбируются на полярном адсорбенте (силикагеле SiO2), связываясь с адсорбентом полярными участками молекул.

|

|
а) Силикагель б) Сажа
Рис. 27. Ориентация молекул ПАВ на границе раздела твердое тело – раствор:
а) – силикагель – бензол; б) – сажа – вода
В системе полярный растворитель - малополярный адсорбент - адсорбция ПАВ подчиняется правилу Дюкло-Траубе.
При адсорбции ПАВ из неполярных растворителей полярными адсорбентами выполняется обращенное правило Дюкло-Траубе:с ростом длины радикала адсорбция уменьшается. Обращение правила объясняется тем, что с ростом углеводородной цепи растворимость ПАВ в неполярных растворителях увеличивается.
Закономерности распределения веществ между раствором и твердой фазой важны для понимания процессов обмена веществ. Законы распределения твердого вещества между неполярной фазой липидного слоя биомембран и полярной фазой (внутри- и межклеточной жидкостью) управляют поступлением питательных веществ и удалением продуктов метаболизма. С явлением адсорбции на клеточных мембранах из полярных биосред организма связано физиологическое действие многих лекарств (барбитураты, анестезирующие средства и др.) и токсическое действие ОВ (например, иприта и люизита). Существует специальный механизм окисления неполярных или малополярных чужеродных для организма веществ (ксенобиотиков), в результате чего эти вещества приобретают полярные группировки, и их способность адсобироваться на липидных мембранах падает. В итоге они переходят в водную фазу, откуда уже могут покинуть организм с выделениями.
Молекулярная адсорбция твердыми адсорбентами из растворов широко распространена в медицинской практике. Уже давно при отравлениях растительными ядами, токсинами, малополярными лекарствами (например, барбитуратами) применяют активированный уголь для их удаления из пищеварительного тракта. В настоящее время осуществляют сорбционную детоксикацию крови и лимфы больного пропусканием их через активированный уголь. Гемо- и лимфосорбция позволяют удалить из организма токсичные органические жидкости (например, дихлорэтан и другие галогенопроизводные), фосфорорганические соединения и др. Адсорбцию используют для очистки питьевой воды и сточных вод.
§13.1.2. Адсорбция сильных электролитов.
Адсорбция из растворов электролитов осложняется ярко выраженными электростатическими взаимодействиями, приводящими к образованию на поверхности адсорбента двойного электрического слоя (ДЭС).
Различают следующие разновидности адсорбции из растворов электролитов; а) эквивалентную; б) обменную; в) избирательную.
При эквивалентной адсорбциикатионы и анионы адсорбируются в таких количествах, чтобы в целом был обеспечен суммарный нулевой заряд. Эквивалентную адсорбцию формально можно рассматривать как адсорбцию неэлектролита, так как при этом не возникают отрицательно или положительно заряженные поверхности.
Обменная адсорбция заключается в обмене ионами между адсорбентом и раствором; адсорбенты, способные к обмену катионами, называют катионитами; анионами — анионитами. Ионообменики используют для получения деминерализованной воды, применяются как гемосорбенты. Иониты используют для беззондового определения кислотности желудочного сока.
При избирательной адсорбциина поверхности адсорбента накапливаются либо катионы, либо анионы. Ионы противоположного заряда сохраняют при этом относительную подвижность в растворе. В результате избирательной адсорбции возникают заряженные поверхности.
В соответствии с правилом Панета—Фаянса из раствора преимущественно адсорбируются ионы, которые входят в состав кристаллической решетки, или им изоморфные. Например, на поверхности кристаллов сульфата бария могут адсорбироваться из раствора, содержащего хлорид бария и нитрат стронция, ионы бария (входят в кристаллическую решетку) или ионы стронция (изоморфны ионам бария); поверхность твердой фазы сульфата бария приобретает положительный заряд. Если тот же адсорбент контактирует с растворами сульфата натрия и перманганата калия, то избирательно будут адсорбироваться на его поверхности сульфат-ионы и изоморфные им перманганат-ионы. Поверхность твердой фазы приобретает отрицательный заряд. Ионы адсорбируются тем лучше, чем больше их радиус и заряд.
Адгезия и когезия.
( Cамостоятельная работа студентов)
Адгезия. Адгезия (adhesion — прилипание) — взаимодействие между приведенными в контакт разнородными поверхностями, возникающее как результат действия межмолекулярных или химических связей. Адгезия определяет прочность склеивания, связи полимеров с наполнителями, лаковых пленок с подложками и т.д.
Когезия (cohesion — слипание) — обширное понятие, описывающее сцепление частиц: молекул, атомов или ионов, составляющих одну фазу физического тела, под действием различных сил притяжения. Когезия определяет прочностные свойства как однородных по химическому составу твердых тел, так и различных композиций, но в последнем случае присутствует и адгезионная составляющая.
Адгезив (аdhesive— клеющее вещество) — термин, объединяющий различные вещества, основным назначением которых является создание адгезионного контакта: клеи, подслои, адгезионные агенты.
Праймер (рrimer — грунтовка) — специальный «грунтовочный» слой, модифицирующий, приспосабливающий поверхность субстрата под нанесение адгезива.
Адгезию частиц оценивают силой адгезии, которая равна внешней силе отрыва, но противоположно направлена. Сила отрыва может быть определена непосредственно экспериментально.
Смачиваниепроявляется в искривлении поверхности жидкости (образовании мениска), растекании жидкости. Смачивание наблюдается на границе раздела трех фаз: твердого тела, жидкости и газа.
Количественной характеристикой смачивания является краевой угол (Ө) – угол между смачиваемой поверхностью твердого тела и касательной к поверхности жидкости в точке соприкосновения с твердой фазой. Значение угла Ө связано с поверхностным натяжением на границах раздела фаз: твердое тело— газ (σтг), твердое тело—жидкость (σтж), жидкость —газ (σжг) — уравнением Юнга:
соs Ө =(σтг - σтж) / σтж

а б
Рис.28. Растекание капли на твердой повехности: а — смачивание; б — несмачивание
Условие Ө → 0 отвечает полному смачиванию; условие 0 < 8 < 90° - неполному смачиванию (рис. 28, а); при Ө > 90° поверхность твердого тела не смачивается (рис. 28, б).
Эффективными регуляторами смачивания являются ПАВ.
Равновесную работу адгезии жидкости рассчитывают по уравнению
Wа = σжг + σтг - σтж, или Wа = σжг (1 + cosӨ).
Адгезия обусловлена прежде всего различными видами взаимодействий между молекулами или атомами. Эти взаимодействия приводят к образованию межмолекулярных и химических связей (ковалентной, донорно-акцепторной, ионной, электростатической, ван-дер-ваальсовой).
Проявление различных взаимодействий зависит от свойств среды. В газовой и жидкой средах адгезия обусловлена главным образом межмолекулярными и донорно-акцепторными связями. Ионные и ковалентные связи наблюдаются сравнительно редко и мало оказывают влияние на адгезию. Кулоновские силы действуют в основном в газовой (воздушной) среде. В жидкости, содержащей электролиты, которые являются проводниками, влияние куло-новских сил на адгезию вследствие утечки зарядов ничтожно мало. В жидкой среде появляются дополнительные силы, связанные с расклинивающим действием тонкого слоя жидкости между адге-зивом и субстратом, что приводит к снижению адгезии.
Анализ теорий, объясняющих причины адгезии.Согласно адсорбционной теории адгезиипроцесс формирования связи между адгезивом и субстратом определяется адсорбцией молекул адгезива на поверхности субстрата. При формировании пленки из полимерных материалов адгезия будет зависеть от концентрации исходного раствора, природы растворителя, молекулярной массы полимера, температуры среды и других факторов.
Существуетряд теорий, которые определяют величину адгезии в зависимости от природы и числа связей, приходящихся на единицу площади контакта адгезива и субстрата. К их числу относится диффузионная теория. Диффузия макромолекул при адгезии полимеров была доказана прямыми методами. Для осуществления диффузионных процессов необходимо соблюдение двух условий: термодинамического, которое сводится к взаимной растворимости адгезива и субстрата и их совместимости; кинетического, которое обеспечивается подвижностью макромолекул полимеров. При глубинной диффузии происходит размыв границы раздела субстрат—адгезив. Диффузия все же имеет место при адгезии ограниченного числа систем. Она, например, не наблюдается при адгезии на некоторых металлических поверхностях, при формировании покрытия из слоя прилипших частиц и в других случаях.
В настоящее время развита микрореологическая теория адгезии. Суть этой теории заключается в том, что в процессе формирования пленки из расплава происходит заполнение выемов шероховатой поверхности субстрата, увеличивается площадь фактического контакта, а, следовательно, и число связей между адгезивом и субстратом, что приводит к росту адгезии и адгезионной прочности.
Некоторые теории объясняют причины адгезионной прочности наличием двойного электрического слоя при отрыве пленок и его влиянием на адгезионную прочность.
Релаксационная теориярассматривает процессы деформации, возникновение внутренних напряжений и их релаксацию в процессе отрыва пленок. По существу, эта теория определяет влияние на адгезионную прочность процессов, связанных с возникновением внутренних напряжений при отрыве пленок. Следует отметить, что внутренние напряжения могут возникать в процессе формирования пленок, и они могут оказывать влияние на величину адгезии. При этом природа адгезионной связи не изменяется. Возникает лишь условие для изменения адгезии путем уменьшения числа связей, что приводит к ослаблению адгезии.
Практически все виды пломбировочных материалов (амальгамы, цементы, композиты и др.) не обладают самостоятельной адгезией к тканям зуба. Это связано с очень высокой вязкостью материалов в рабочем состоянии, препятствующей образованию адгезионного контакта; отсутствием, как правило, химического сродства одновременно ко всем трем субстратам, оформляющим пломбируемую полость: эмаль, дентин и прокладка; невозможностью создания повышенного давления и температуры при «склеивании». Фиксация пломбы только за счет механического удерживания в полости существенно уменьшает срок ее службы.
Фиксация пломбы к зубу осуществляется стоматологическими адгезивами (клеями), обеспечивающими прочные соединения до 30 Мпа. На этапе подготовки полости к пломбированию проводится обработка ее 37% раствором фосфорной кислоты, растворяющей неорганику, после чего поверхность зуба становится пористой. Затем в образовавшиеся поры проникает адгезив, обеспечивая прочное соединение пломбировочного материала с зубом, при чем, сам процесс затвердевания материала - результат реакции полимеризации.
Дата добавления: 2019-09-30; просмотров: 1434;











