Внутримолекулярная и межмолекулярная дегидратация.
Кислотные катализаторы ускоряют как внутри-, так и межмолекулярную дегидратацию гидроксилсодержащих углеводородов. Активность и селективность катализаторов (помимо условий проведения процесса) зависит от кислотности поверхности.
Рассмотрим пример каталитических превращений этанола на различных образцах промышленного Al2O3, различающихся содержанием технических примесей - SiO2 и Na2O (Табл. 5.22).
Таблица 5.22.
Поведение оксида алюминия в дегидратации этанола.
| Относительная кислотность* (при 175оС) | Содержание примесей, % | Конверсия, % | Селективность, % | Кокс, % | ||
| SiO2 | Na2O | С2Н4 | (С2Н5)О | |||
| 0,021 0,046 0,060 | 0,02 0,01 0,13 | 0,25 0,06 0,03 | 66,1 98,8 85,1 | 25,3 99,2 89,2 | 70,1 0,2 0,1 | 0,1 0,2 0,5 |
* - ммоль NH3, адсорбируемого 1 граммом Al2O3.
Проанализируем данные Таблицы 5.22. Увеличение содержания SiO2 приводит к усилению Бренстедовской кислотности. Увеличение содержания Na2O приводит нейтрализации сильных Бренстедовских кислотных центров, и к стабилизации основных центров. Очевидно, что общая кислотность образцов растет с увеличением содержания SiO2 и уменьшением содержания Na2O.
Установлено, что дегидратация этанола протекает при согласованном действии кислотных протонных и основных каталитических центров:
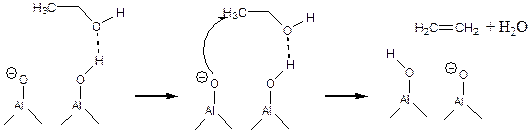 (5.66)
(5.66)
Поэтому наивысшая активность и селективность по этилену наблюдается на образце со средней кислотностью (оптимальное соотношение основных и кислотных центров). Образец с наименьшей кислотностью обладает самой низкой активностью (конверсия) и наименьшей селективностью по этилену. Кроме того было установлено, что дегидратация протекает на кислотных центрах Бренстеда средней силы, а Льюисовские центры практически не катализируют эту реакцию. Этот вывод был сделан на основании того факта, что добавка небольших количеств оснований Льюиса (аммиак, пиридин и т.п.), блокирующих в первую очередь сильные кислотные и апротонные центры, не ингибируют реакцию.
Образование эфира на поверхности Al2O3 протекает по механизму Лэнгмюра-Хиншельвуда, при котором взаимодействие происходит между алкоголятом (С2Н5О-), образовавшемся на основном центре и молекулой этанола, активированной водородной связью на соседнем кислотном центре. Поэтому, чем больше содержание Na2O, тем выше селективность образования эфира.
Важный момент в данном примере - образование кокса. Как видно количество кокса растет пропорционально росту Бренстедовской кислотности. Это связано с тем, что именно на этих центрах образуются промежуточные карбокатионы, инициирующие димеризацию и олигомеризацию этилена. Отложение нелетучих продуктов олигомеризации приводит к блокированию поверхности, снижению каталитической активности и коксообразованию.
Дата добавления: 2020-07-18; просмотров: 785;











