Получение и устойчивость дисперсных систем
Непрерывную фазу дисперсных систем принято называть дисперсионной средой, а совокупность раздробленных частиц – дисперсной фазой.
Размеры частиц дисперсной фазы в общем случае варьируют в широком диапазоне: в высокодисперсных системах, которые называют коллоидно-дисперсными, — от 10~9 до 10~7 м (частицы размером менее 10-9 м образуют истинные растворы); в грубодисперсных системах (эмульсии, суспензии) — от 10-7 до 10-5 м (более крупные частицы рассматривают как отдельные физические тела).
Методы получения дисперсных систем. Основаны либо на дроблении крупных (методы диспергирования), либо на укрупнении мелких (методы конденсации) частиц. И диспергирование, и конденсация могут протекать как без участия химических или физико-химических процессов, так и с их участием, поэтому условно выделяют физические и химические методы получения дисперсных систем.
Диспергирование проводят с использованием коллоидных и шаровых мельниц, с помощью электричества, ультразвука, вибрации (физические методы) или пептизации (химический метод).
Физические конденсационные методы основаны на создании в гомогенной системе пересыщения путем изменения температуры или состава растворителя. Химические конденсационные методы заключаются в проведении реакций, заканчивающихся образованием нерастворимых веществ. Реакции проводят таким образом, чтобы скорость образования частиц дисперсной фазы превышала скорость их роста, так как от соотношения скоростей этих процессов зависит степень дисперсности получаемой системы. Такое условие достигается подбором концентраций реагентов, температурного режима, введением ингибиторов роста кристаллов. Для получения золей методом химической конденсации можно использовать окислительно-восстановительные и обменные реакции.
Методы очистки коллоидных растворов.Коллоидные растворы, полученные одним из рассмотренных методов, содержат примеси растворенных низкомолекулярных веществ и грубодисперсных частиц, наличие которых может отрицательно сказываться на свойствах золей, снижая их устойчивость.
Для очистки коллоидных растворов от примесей используют фильтрацию, диализ, электродиализ, ультрафильтрацию.
Фильтрация основана на способности коллоидных частиц проходить через поры обычных фильтров. При этом более крупные частицы задерживаются. Фильтрацию используют для очистки коллоидных растворов от примесей грубодисперсных частиц.
Диализ — удаление с помощью мембран низкомолекулярных соединений из коллоидных растворов и растворов высокомолекулярных соединений. При этом используют свойства мембран пропускать молекулы и ионы малого размера и задерживать коллоидные частицы и макромолекулы. Малые молекулы и ионы диффундируют через мембрану в растворитель и при его достаточно частой замене почти нацело удаляются из диализуемой жидкости. В качестве мембран для диализа применяют различные пленки: естественные (бычий или свиной мочевой пузырь, плавательный пузырь рыб) и искусственные (из нитроцеллюлозы, ацетилцеллю-лозы, целлофана, желатина и других материалов).
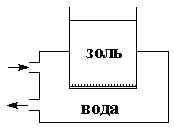
Прибор для очистки золей методом диализа называется диализатором; простейший диализатор представляет собой сосуд, нижнее отверстие которого затянуто полупроницаемой мембраной (рис. 4.17). Золь наливают в сосуд и помещают последний в ёмкость с дистиллированной водой (обычно проточной); ионы и молекулы примесей диффундируют через мембрану в растворитель.
| 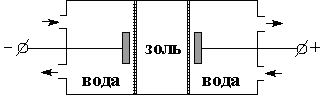
| |
| Рис. 4.17 Схема диализатора | Рис. 4.18 Схема электродиализатора | |
Диализ является очень медленным процессом; для более быстрой и полной очистки золей применяют электродиализ..
Электродиализиспользуют для увеличения скорости диализа низкомолекулярных электролитов. С этой целью в диализаторе создают постоянное электрическое поле с разностью потенциалов 20 — 250 В/см (и выше). Электродиализатор состоит из трех частей; в среднюю часть, отделенную от двух других полупроницаемыми мембранами, за которыми помещены электроды, наливается золь (рис. 4.18)
При подключении к электродам разности потенциалов катионы содержащихся в золе электролитов диффундируют через мембрану к катоду, анионы – к аноду. Преимущество электродиализа заключается в возможности удаления даже следов электролитов (необходимо помнить, что степень очистки ограничивается устойчивостью коллоидных частиц; удаление из золя ионов-стабилизаторов приведет к коагуляции). Проведение диализа в электрическом поле позволяет ускорить очистку коллоидного раствора в несколько десятков раз.
Ультрафильтрациюприменяют для очистки систем, содержащих частицы коллоидных размеров (золи, растворы высокомолекулярных соединений, взвеси бактерий и вирусов). В основе метода лежит продавливание разделяемой смеси через фильтры с порами, пропускающими только молекулы и ионы низкомолекулярных веществ. В определенной степени ультрафильтрацию можно рассматривать как диализ под давлением. Ультрафильтрацию широко используют для очистки воды, белков, нуклеиновых кислот, ферментов, витаминов, а также в микробиологии при определении размеров вирусов и бактериофагов.
Строение мицелл.
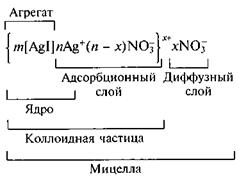
Структурную единицу коллоидного раствора называют мицеллой.Множество формульных единиц (до нескольких тысяч), соединяясь вместе, образуют агрегат.Ионы, сообщающие поверхности агрегата определенный заряд, называют потенциалопределяющими ионами. Потенциалопределяющие ионы удерживаются на поверхности агрегата за счет межмолекулярных взаимодействий. Агрегат вместе со слоем потенциалопределяющих ионов принято называть ядромколлоидной частицы. Противоионы имеют знак заряда, противоположный потенциалопределяющим ионам.
На противоионы со стороны ядер коллоидных частиц действует электростатическое притяжение. В то же время противоионы могут принимать участие в тепловом движении как кинетически самостоятельные единицы.
Таким образом, одни противоионы достаточно прочно связаны с поверхностью ядер, вместе с потенциалопределяющими ионами они образуют адсорбционный слой. Другие противоионы образуют диффузный слой. Агрегат вместе с адсорбционным слоем образует гранулумицеллы. Знак заряда гранулы определяется знаком заряда потенциалопределяющих ионов, а размер заряда — толщиной диффузного слоя. Чем меньше диффузный слой, тем больше противоионов находится в адсорбционном слое и тем меньше заряд. Гранула и противоионы диффузного слоя образуют мицеллу. Мицелла электронейтральна.
Рассмотрим строение мицелл золей, образующихся в результате взаимодействия растворов нитрата серебра и йодида калия. Золь можно получить в условиях избытка либо нитрата серебра, либо йодида калия:
AgNO3 + KI → KNO3 + AgI ↓
1. Частицы золя, полученного при избытке нитрата серебра, положительно заряжены. После того как образуются агрегаты AgI, в растворе останутся ионы К+, NО3- и Аg+. В соответствии с правилом Панета— Фаянса кристаллическую решетку йодида серебра из присутствующих в растворе ионов могут достроить только ионы серебра. Они и сообщают поверхности агрегатов положительный заряд. Противоионами в рассматриваемом примере являются нитрат-ионы. Схема строения мицеллы такого золя имеет вид:
|
{ m [AgI] *nAg+*(n-x)NO3–}x+*xNO3– 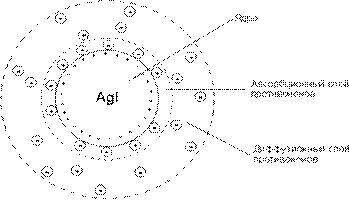
где m — число формульных единиц AgI в агрегате; п — число потенциалопределяющих ионов; x— число противоионов в составе диффузного слоя.
2. Частицы золя, полученного при избытке йодида калия, отрицательно заряжены. После того как образуются агрегаты AgI, в растворе останутся ионы К+, NO3- и I- . В соответствии с правилом Панета—Фаянса кристаллическую решетку йодида серебра из присутствующих в растворе ионов могут достроить только йодид-ионы (потенциалопределяющие ионы). Противоионами являются ионы калия. Схема строения мицеллы такого золя имеет вид:
{ m [AgI] · nI– · (n-x)K+}x– · x K+
В результате этого микрокристалл приобретает отрицательный либо положительный заряд; ионы, сообщающие ему этот заряд, называются потенциалопределяющими, а сам заряженный кристалл – ядром мицеллы (это твердая фаза). Заряженное ядро притягивает из раствора ионы с противоположным зарядом – противоионы; на поверхности раздела фаз образуется двойной электрический слой. Некоторая часть противоионов адсорбируется на поверхности ядра, образуя т.н. адсорбционный слой противоионов; ядро вместе с адсорбированными на нем противоионами называют коллоидной частицей или гранулой. Остальные противоионы, число которых определяется, исходя из правила электронейтральности мицеллы, составляют диффузный слой противоионов; противоионы адсорбционного и диффузного слоев находятся в состоянии динамического равновесия адсорбции – десорбции.
В мицелле с ионным стабилизатором, как во всякой гетерогенной системе, в которой на границе раздела фаз имеется двойной электрический слой, различают два потенциала: межфазный φмф и электрокинетический, или ζ - потенциал ( дзета – потенциал).
Межфазным потенциалом называется потенциал ДЭС на границе раздела между твердой и жидкой фазами в мицелле.
Электрокинетическим потенциалом ( ζ - потенциалом ) называется потенциал на границе скольжения между адсорбционной и диффузионной частями ДЭС мицеллы.
Наличие электрического заряда на поверхности коллоидных частиц обусловливает их способность к электрофорезу.
Электрофорезомназывают перемещение в электрическом поле частиц дисперсной фазы относительно дисперсионной среды. Частицы с положительным зарядом перемещаются к катоду, с отрицательным – к аноду.
Дисперсные системы в отличие от истинных растворов термодинамически неустойчивы. Под устойчивостьюсистемы понимают ее способность сохранять во времени все параметры без обмена энергией и веществами с окружающей средой.
Устойчивость дисперсных систем.
Различают седиментационную и агрегативную устойчивость дисперсных систем.
Седиментационная устойчивость— это устойчивость частиц к оседанию под действием силы тяжести; седиментационно неустойчивые системы с течением времени расслаиваются: легкие частицы всплывают на поверхность, а тяжелые – оседают на дно.
Агрегативная устойчивость— это способность дисперсных систем сохранять размер частиц и их индивидуальность. В агрегативно неустойчивых системах проходят процессы укрупнения частиц.
Грубодисперсные системы седиментационно неустойчивы. Частицам дисперсной фазы таких систем не свойственно броуновское движение, поскольку, чем крупнее частица, тем больше столкновений с молекулами дисперсионной среды она испытывает в единицу времени и тем больше вероятность того, что импульсы будут взаимно скомпенсированы.
Коллоидно-дисперсные системы являются седиментационно устойчивыми, так как частицы их дисперсных фаз принимают участие в броуновском движении (вероятность взаимной компенсации импульсов при столкновениях молекул с мелкой частицей уменьшается). Однако коллоидно-дисперсные системы являются агрегативно неустойчивыми. Это связано с большой удельной поверхностью дисперсной фазы и, как следствие, большим избытком энергии Гиббса на границах раздела фаз.
Потеря коллоидно-дисперсной системой агрегативной устойчивости называется коагуляцией.
До тех пор, пока процессы агрегации не приводят к нарушению седиментационной устойчивости ( частицы становятся крупнее, но по размерам не выходят за границу коллоидно-дисперсного состояния), внешне коагуляция может проявляться только в изменении цвета золя. По мере укрупнения частиц система начинает постепенно терять и седиментационную устойчивость — появляется помутнение, а затем выпадает осадок.
Особенно золи чувствительны к добавлению электролитов, которые уменьшают заряд коллоидных частиц за счет сжатия диффузного слоя. Другими словами, электролиты значительно ослабляют действие стабилизирующего фактора: снижение электрического заряда на частицах уменьшает электростатическое отталкивание одноименно заряженных частиц, которые легче агрегируют.
Электролитная коагуляция золей проявляется только при достижении некоторой критической концентрации ионов в золе Сп.к, называемой порогом коагуляции. Величину, обратную порогу коагуляции, называют коагулирующей способностью, или коагулирующим действием (γ).
Правило Шульце–Гарди. Коагулирующее действие электролитов на коллоидные растворы
с ионным стабилизатором подчиняется правилу Шульце-Гарди:
Коагуляцию коллоидных растоворов вызывают любые ионы, которые имеют знак заряда, противоположный заряду гранул. Коагулирующее действие ионов ( γ ) тем сильнее, чем выше заряд иона- коагулятора.
Отношение показателей коагулирующей способности одно-, двух- и трехзарядных ионов составляет приблизительно 1 : 60 : 700, т.е. пропорционально шестой степени заряда иона, имеющего противоположный знак заряда по сравнению с коллоидной частицей. С ростом коагулирующей способности иона-коагулятора уменьшается порог коагуляции: γ = 1/ Спк
Порог коагуляции рассчитывают по формуле:
С п.к = 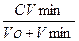
где V0 — объем золя, л; Vmin— минимальный объем раствора электролита, вызывающий коагуляцию золя, л; С — концентрация электролита в растворе, моль/л.
Процесс дезагрегации частиц, обратный процессу коагуляции, называют пептизацией. В системе возможно установление равновесия между процессами агрегирования и дезагрегирования частиц фазы; этому состоянию соответствует определенная концентрация частиц в свободнодисперсной системе, равновесная по отношению к осадку.
Пептизация тем более вероятна, чем меньше времени прошло с момента коагуляции. Это объясняется тем, что коагулят (осадок) «стареет», коагуляционные контакты в нем постепенно переходят в конденсационные, частицы фазы срастаются и коагуляция принимает необратимый характер.
Пептизацию можно вызвать отмыванием коагулята водой от электролита, вызвавшего коагуляцию золя, — концентрация электролита при этом снижается и становится меньше порога коагуляции. Чаще всего пептизацию вызывают добавлением веществ, которые способны восстановить утраченный заряд коллоидных частиц. Пептизаторами могут быть ионы, способные к адсорбции на поверхности агрегатов по правилу избирательной адсорбции Панета— Фаянса (адсорбционная пептизация), или вещества, реагирующие с частью коагулята с образованием таких ионов. В последнем случае пептизацию называют диссолюционной, илихимической.
Например, при пептизации осадка гидроксида железа(Ш) раствором хлорида железа(Ш) происходит адсорбция ионов Fе3+ на частицах осадка, мицелла имеет следующее строение:
{m [Fе(ОН)3] n Fе3+3(n- х)С1-}3х+ЗхС1-
В данном случае реализуется механизм адсорбционной пептизации.
Примером диссолюционной (химической) пептизации является пептизация осадка гидроксида железа(Ш) соляной кислотой. Происходит химическая реакция НСl с частью осадкa:
Fe (ОН)3 + Н+ → Fe (ОН)2+ + Н20
Fe (ОН)2+ + FеО+ + Н20
а затем адсорбция ионов пептизатора на частицах осадка. Строение мицеллы полученного золя описывает формула
{m [Fе(ОН)3]n FеО+(n- х)С1-}х+хС1-
Пептизацию можно проводить также растворами ПАВ. Молекулы ПАВ, адсорбируясь на частицах осадка, повышают сродство дисперсной фазы к дисперсионной среде в соответствии с правилом выравнивания полярностей Ребиндера, т.е. повышают в некоторой степени лиофильность лиофобного золя.
Ускорить процесс пептизации можно повышением температуры и перемешиванием.
Дата добавления: 2019-09-30; просмотров: 895;











