Задание для самостоятельной подготовки
При подготовке к занятию необходимо усвоить следующие основные понятия:
1) структура дисперсных систем; дисперсная фаза, дисперсионная среда; степень дисперсности; классификация дисперсных систем;
2) строение частиц дисперсной фазы лиофобных и лиофильных мицеллярных коллоидных систем; строение двойного электрического слоя; мицелла, агрегат, ядро (гранула);
3) механизм возникновения заряда коллоидной частицы;
4) влияние электролитов на электрокинетический потенциал;
5) кинетическая и термодинамическая устойчивость коллоидных систем; коагуляция и факторы, ее вызывающие; порог коагуляции;
6) правило Шульца—Гарди; коагуляции золей смесями электролитов;
7) методы получения и очистки коллоидных растворов; диализ, электродиализ, ультрафильтрация.
Лабораторный практикум.
“Определение порогов коагуляции”.
Цель работы:
1) провести коагуляцию тремя электролитами, содержащими ионы-коагуляторы разной величины заряда;
2) вычислить пороги коагуляции для каждого электролита и их соотношения;
3) проверить выполнение правила Шульце-Гарди.
Ход работы.
Определяют порог коагуляции титрованием золя раствором электролита. В 6 пробирок одинакового диаметра наливают из пробирок по 5 мл приготовленного золя. Пробирки ставят в штатив. Сначала проводят коагуляцию золя электролитом с однозарядным ионом-коагулятором. Для этого берут в руки две пробирки с золем и прибавляют каплями из бюреток в одну – электролит, а в другую (контрольную) – воду. Пробирки встряхивают. Каждый раз сравнивая титруемый золь с контрольной пробиркой. Отмечают визуальные признаки коагуляции (потемнение или образование хлопьев) и фиксируют по бюретке отвечающий ей объём электролита. Опыт повторяют ещё два раза с оставшимися четырьмя пробирками. Затем аналогично проводят коагуляцию электролитами, содержащими двух- и трёхзарядные ионы-коагуляторы.
Экспериментальные данные заносят в таблицу:
| Электролит | Концентрация электролита, моль/л | Объём Электролита, мл. | Порог Коагуляции, Моль/л |
| 1. 2. 3. |
Пороги коагуляции вычисляют на основе экспериментальных данных по формуле:
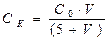
где СК – порог коагуляции, моль/л; С0 – концентрация исходного электролита, моль/л; VK – объём электролита вызвавшего коагуляцию 5 мл золя, мл.
Особенности растворения полимеров.Размеры макромолекул высокомолекулярных соединений (ВМС) соизмеримы с размерами коллоидных частиц, что обусловливает общность ряда свойств, характерных для коллоидных растворов и растворов ВМС.
К таким свойствам относят малую скорость диффузии растворенных частиц, неспособность их проникать через мембраны, эффект Фарадея—Тиндаля и др. Однако растворы ВМС являются истинными, поскольку удовлетворяют основным критериям истинных растворов: самопроизвольность образования, гомогенность, термодинамическая устойчивость, равновесность.
Равновесие в растворах ВМС устанавливается медленнее, чем в истинных растворах, и растворению, как правило, предшествует набухание. Набуханием называют самопроизвольный процесс односторонней диффузии низкомолекулярного растворителя в полимер, сопровождающийся увеличением объема и массы ВМС.
Различают неограниченное и ограниченное набухание. В первом случае полимер поглощает жидкость, а потом при той же температуре постепенно переходит в раствор. Пример неограниченного набухания — растворение желатина или крахмала в горячей воде. При ограниченном набухании процесс практически останавливается на стадии образования гетерогенной системы, состоящей из двух фаз: набухший полимер и низкомолекулярный растворитель. В этом случае равновесной системой является гель. Пример ограниченного набухания — набухание желатина или крахмала в холодной воде, набухание резины в бензоле. Тип набухания зависит от гибкости полимерной цепи: чем более гибкой является полимерная цепь, тем больше степень набухания и тем выше вероятность образования раствора.
Количественно способность полимера набухать в тех или иных растворителях характеризуют степенью набухания:
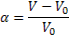
где V, V0 — объем образца полимера до и после набухания соответственно.
На практике для оценки способности растворителя растворять или вызывать набухание того или иного полимера обычно руководствуются эмпирическим правилом: подобное растворяется в подобном (неполярные полимеры растворяются в неполярных растворителях, а полярные — в полярных).
Для амфотерных полиэлектролитов степень набухания зависит от показателя рН среды. Так, белки в изоэлектрическом состоянии имеют минимальные значения степени гидратации, набухания, растворимости. Зависимость степени набухания белка от значения рН среды выражается кривой с двумя максимумами и одним минимумом, который соответствует изоэлектрической точке.
ЛИТЕРАТУРА
ОСНОВНАЯ ЛИТЕРАТУРА
- Ю. А. Ершов, В. А. Попков и др. Общая химия. Биофизическая химия. Химия биогенных элементов. Москва, «Высшая школа», 1993
- Н.А. Тюкавкина, Ю.И. Бауков. Биоорганическая химия. Москва, Дрофа, 2005
- Р. А. Хмельницкий. Физическая и коллоидная химия. Москва, «Высшая школа», 1988
- А. В. Бабков и др. Практикум по общей химии с элементами количественного анализа. Москва, «Высшая школа», 1978
ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА
1. В. И. Слесарев. Химия. Основы химии живого. С-Петербург, «Химиздат», 2000.
2. К.Н. Зеленин. Химия. С-Петербург, Химиздат, 1997.
3. Н.Л. Глинка. Задачи и упражнения по общей химии. Ленинград, «Химия», 1983.
4. А. И. Болдырев. Физическая и коллоидная химия. Москва, «Высшая школа», 1983.
5. К.А. Макаров, М.З. Штейнгарт. Сополимеры в стоматологии. М.; Медицина, 1982.
6. Профилактическая стоматология. М., Медицина, 2004.
7. Егоров А.С., Иванченко Н.М., Шацкая К.П. Химия внутри нас: Введение в бионеорганическую и биоорганическую химию. – Ростов н/Д: Феникс, 2004. – 192 с.
8. А.Э.Шарпенак, С.А.Косенко «Практикум по органической химии»,
Издательство «Высшая школа» - 1965г. Опыты №74,78,79 стр.78-81.
9. А.Я.Рево, В.В.Зеленкова «Малый практикум по органической химии»,
Издательство «Высшая школа», 1980г. Стр. 62-66
10. Б.Н. Степаненко «Курс органической химии», 1979, стр. 354-364, 366-
367.
11. «Руководство к лабораторным занятиям по биоорганической химии»
под редакцией Н.А. Тюкавкиной, 1985, стр. 201-215.
12. Т.Т. Березов, Б.Ф. Коровкин «Биологическая химия», М.1982, раздел
«Химия углеводов».
пиррол фуран тиофен индол
|
пиразол имидазол тиазол оксазол
|
пиридин хинолин изохинолин
|
пиримидин пурин ? ?
Дата добавления: 2019-09-30; просмотров: 730;











