ОБЪЁМ, УДЕЛЬНЫЙ ОБЪЁМ, МАССА И ПЛОТНОСТЬ НЕФТЕПРОДУКТА.
Объём газов V измеряют в кубических метрах (м3).Вследствие того, что объём газов сильно изменяется при нагревании, охлаждении и сжатии, за его единицу принимают 1 м3 газа при нормальных условиях (t=00C, P=101,3кПа). Т.к. любой газ способен расширяться, следовательно, знание объёма недостаточно для определения его массы (количества). В любом объёме, целиком заполненным газом, его количество (масса) может быть различным.
Масса (т, кг) – мера вещества какого-либо тела (жидкости, газа) в состоянии покоя; величина, характеризующая инерционные и гравитационные свойства тела.
Удельным объёмом называется объём, занимаемый 1 килограммом массы газа, пара или жидкости (м3/кг).
Плотностьюρ называется масса 1 м3 газа, паров, жидкости или твёрдого тела (величина, обратная удельному объёму). Для нефтей и их узких фракций плотность принято выражать абсолютной и относительной величиной.
Абсолютная плотность – масса единицы объема, измеряется в кг/м3 или г/см3 при стандартных условиях (t = 20°С и Р = 101,3 кПа).
Относительная плотность – величина безразмерная, представляет собой отношение плотностей нефтепродукта и воды при определенных температурах:
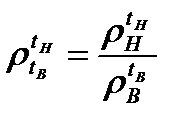 , (4,1)
, (4,1)
где 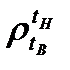 – относительная плотность;
– относительная плотность; 
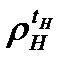 – плотность нефтепродукта при температуре tН, кг/м3 (г/см3);
– плотность нефтепродукта при температуре tН, кг/м3 (г/см3); 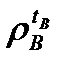 – плотность воды при температуре tВ, кг/м3 (г/см3).
– плотность воды при температуре tВ, кг/м3 (г/см3).
В России приняты tН = 20°С и tВ = 4°С, поэтому относительная плотность обозначается 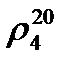 . Численно абсолютная (в г/см3) и относительная плотность в этом случае совпадают, так как плотность воды при 4оС равна единице.
. Численно абсолютная (в г/см3) и относительная плотность в этом случае совпадают, так как плотность воды при 4оС равна единице.
Для углеводородных и других газов относительную плотность принимают при 20оС по отношению к плотности воздуха при той же температуре, т.е.:
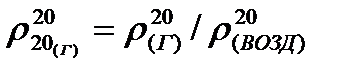 (4,2)
(4,2)
Зная состав газовой смеси и плотность её компонентов, по правилу смешения можно определить среднюю плотность этой смеси по формуле:
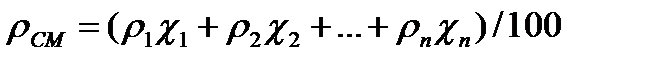 (4,3)
(4,3)
где 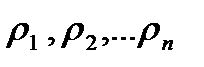 – плотность углеводородных компонентов газа;
– плотность углеводородных компонентов газа;
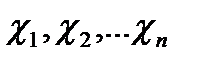 – содержание компонентов, об.%.
– содержание компонентов, об.%.
Закон Авогадро позволяет определять плотность любого газа при нормальных условиях (0оС и 101,3 кПа) по его молекулярной массе:
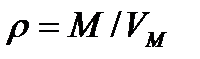 (4,4)
(4,4)
и относительную плотность газа по отношению к воздуху:
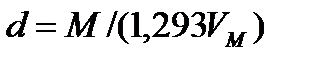 (4,5)
(4,5)
где ρ – плотность данного газа, кг/м3; М – молекулярная масса газа, кг: VМ – молекулярный объём газа, м3/кмоль; d – относительная плотность по отношению к воздуху – безразмерная величина; 1,293 – плотность воздуха, кг/м3 при нормальных условиях.
Таблица 4.2.1Некоторые физические параметры углеводородных газов
| Молекулярная масса М, кг/кмоль | Молекулярный объём VМ, м3/кмоль | ρ газовой фазы при 0оС и 101,3 кПа | Относительная ρ газа по воздуху, d | |
| Метан СН4 | 16,04 | 22,38 | 0,717 | 0,554 |
| Этан С2Н6 | 30,07 | 22,174 | 1,356 | 1,0487 |
| Пропан С3Н8 | 44,097 | 21,997 | 2,0037 | 1,555 |
| Н-Бутан С4Н10 | 58,124 | 21,50 | 2,7023 | 2,0905 |
| I-Бутан С4Н10 | 58,124 | 21,743 | 2,685 | 2,0634 |
| Н-Пентан С5Н12 | 72,146 | 20,87 | 3,457 | 2,6736 |
Дата добавления: 2016-12-16; просмотров: 4452;











