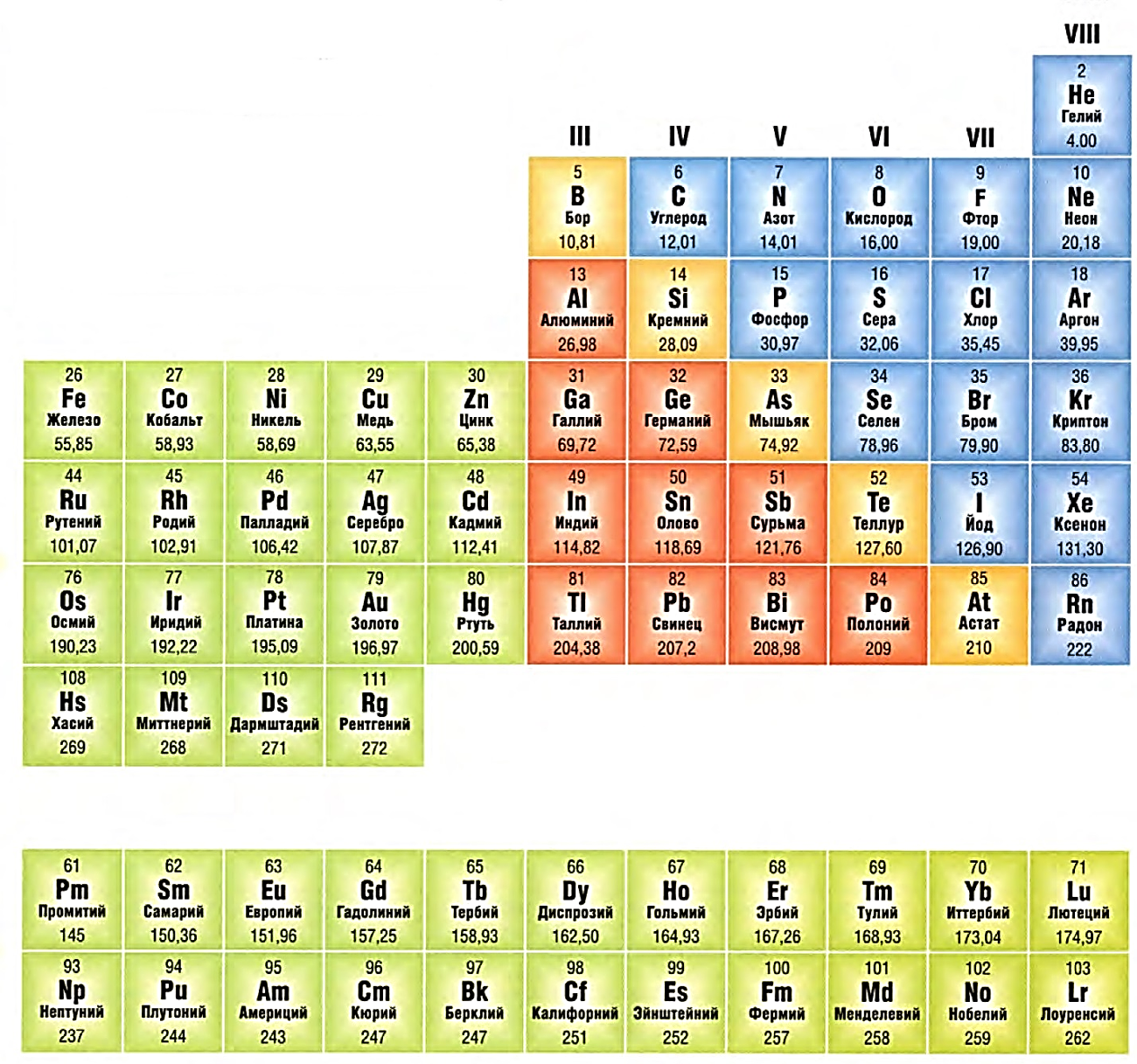
Периодическая система элементов. Атомный номер и масса
Периодическая система элементов разработана российским химиком Д. И. Менделеевым в 1869. Он расположил элементы в таблице согласно их атомарному весу и характеру химических свойств. Хотя в настоящее время известно больше элементов, таблица остается в основном без изменений и используется химиками всех стран.
Группы. Восемь вертикальных колонок элементов, обозначаемых I-VIII, расположены слева направо периодической таблицы. Они называются группами. Каждая группа содержит элементы, сходно вступающие в химические реакции, так как электроны в их атомах похоже расположены вокруг ядра. Наряду с номером каждая группа имеет название.

- Все щелочные металлы (группа I) имеют на внешнем энергетическом уровне один электрон. Он легко удаляется, делая эти элементы высокореакционными.
- Галогены (группа VII) также весьма реакционноспособны, поскольку им не хватает всего одного электрона, чтобы полностью заполнить внешний уровень.
- Напротив, инертные газы (группа VIII) имеют заполненные внешние уровни и практически не вступают в реакции.
- При передвижении по группе сверху вниз некоторые свойства элементов изменяются: возрастает диаметр атомов; атомы легче отдают свои наиболее удаленные от ядра электроны; возрастает и плотность элементов.
Периоды. Каждый горизонтальный ряд в таблице называют «периодом». При переходе слева направо возрастает число электронов на внешнем уровне.
- Элементы изменяются по своим свойствам от металлических к неметаллическим.
- Точки плавления элементов последовательно возрастают, достигая максимума в IV группе (углеродные элементы), и вновь уменьшаются до группы VIII (инертные газы).

Лист меди. Подобно многим переходным металлам, медь хорошо проводит тепло
Переходные элементы. В середине периодической таблицы - от скандия до цинка, от иттрия до кадмия, от гафния до ртути - расположены переходные металлы. Их незаполненные электронные подоболочки не являются самыми крайними. Эти элементы имеют высокую плотность и хорошо проводят тепло и электричество.
Последовательность переходных металлов нарушается двумя семействами: лантаноидами (57-71) и актиноидами (89-103).
Особо тяжелые элементы - трансактиноиды (104 и выше) «искусственные», поскольку их можно получить только в ядерных реакторах или ускорителях частиц.

Читаем периодическую таблицу
Каждая клетка периодической таблицы дает информацию по 4 характеристикам элемента
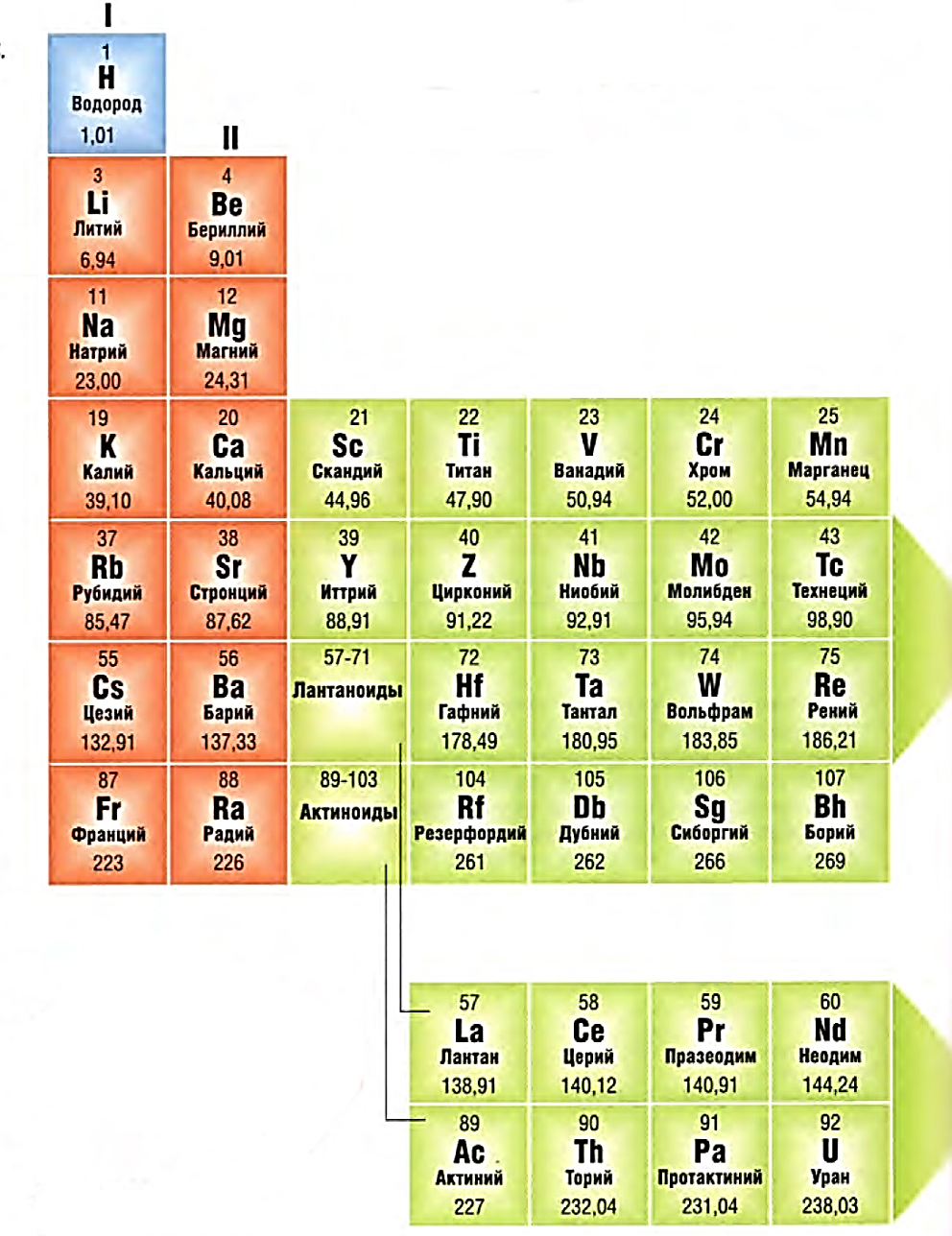
Атомный номер и масса. Атомный номер. Число протонов в ядре каждого атома элемента называется атомным номером этого элемента.
Относительная атомная масса. Мерой того, насколько атом одного элемента тяжелее атома любого другого элемента, является относительная атомная масса. Каждый протон и нейтрон приблизительно равны одной единице атомной массы. Так, углерод, имеющий в ядре 6 протонов и 6 нейтронов, обладает относительной массой 12, а водород с одним протоном имеет относительную массу 1.
Иногда атом какого-то элемента содержит большее или меньшее число нейтронов в ядре - его называют изотопом. Элемент может иметь несколько изотопов с различными атомными массами. В этом случае атомная масса, указанная в таблице, является средней для изотопов, найденных в типичном образце этого элемента.

Самородное серебро. Подобно своим соседям по периодической таблице меди и золоту, серебро хорошо проводит электрический ток, и его широко применяют в электротехнике.
Металлы, неметаллы и металлоиды. Периодическая таблица содержит металлы, неметаллы, металлоиды и переходные элементы.
Металлы. Большинство металлов проявляют следующие свойства:
- Твердые при комнатной температуре.
- Непрозрачные.
- Хорошие проводники тепла и электричества.
- Обладают ярким блеском после полировки В твердом состоянии имеют кристаллическую структуру.
Неметаллы. Типичный неметаллический элемент - газ при комнатной температуре, плохой проводник тепла и электричества.
Металлоиды. Металлоиды, или полуметаллы, обладают свойствами как металлов, так и неметаллов.
Дата добавления: 2022-12-02; просмотров: 2444;











