Скорость химической реакции
Запишем уравнение элементарной химической реакции в общем виде:
аА + bВ = dD + еЕ,
где А, В — исходные вещества, D, Е — продукты реакции, строчными буквами (а, b, d, е) обозначены стехиометрические коэффициенты.
Напомним, что реакция, протекающая слева направо и отражающая процесс взаимодействия исходных веществ, называется прямой реакцией. Реакция, идущая в обратном направлении, называется обратной.
Построим график, на оси ординат которого отложим концентрацию одного (любого) из компонентов системы, а на оси абсцисс — время (Рис.7.1).
По мере протекания химической реакции концентрации исходных веществ уменьшаются, а концентрации продуктов реакции увеличиваются. Выберем два момента времени t1 и t2. Им будут соответствовать концентрации с1 и с2. Скорость гомогенной химической реакции определяется как изменение концентрации любого из веществ в единицу времени, что математически можно выразить так:
V = 
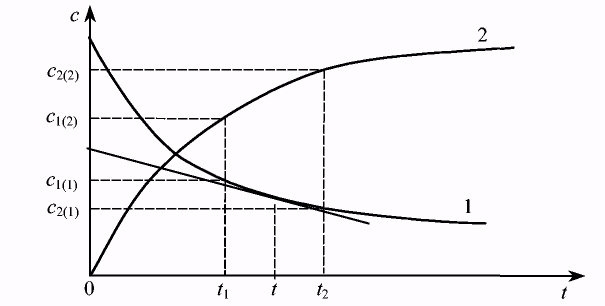
Рис. 7.1. Зависимость концентраций одного из исходных веществ (I) и одного из продуктов реакции (2) от времени.
Если скорость реакции определять по одному из исходных веществ, то мы получим отрицательное значение, т.к. С2(1)<C11(1). Но это не означает, что скорость реакции отрицательная величина, чего не может быть по физическому смыслу. Знак «минус» показывает, что концентрация исходного вещества во времени уменьшается. В то же время скорость обратной реакции будет со знаком «плюс», т.е. концентрация продукта увеличивается. Приведенное выше уравнение определяет среднюю скорость реакции за выбранный промежуток времени. Если выбрать другой временной интервал, то ему будет соответствовать другая средняя скорость. Исследователя же интересует «истинная скорость» реакции в данный момент времени. К ее получению можно приблизиться, уменьшая временной интервал. Тогда истинная скорость реакции будет равна пределу отношения изменения концентрации к промежутку времени при ∆t→ 0:

Этот предел равен производной, которую можно найти как тангенс угла наклона касательной в точке, соответствующей данному моменту времени. Поэтому истинную скорость называют еще и мгновенной.
Очевидно, что это определение не однозначно. Если определять скорость реакции по концентрациям различных веществ, мы получим разные результаты, поэтому необходимо указывать, по какому из веществ была определена скорость реакции, или использовать другое соотношение:
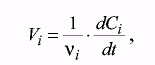
где νi - стехиометрический коэффициент в уравнении реакции.
Скорость гетерогенной химической реакцииопределяется количеством молей образовавшегося вещества на единицу поверхности раздела фаз в единицу времени, что математически можно выразить так:
 , где ∆n - количество молей образовавшегося вещества, S - площадь поверхности раздела фаз, время образования вещества.
, где ∆n - количество молей образовавшегося вещества, S - площадь поверхности раздела фаз, время образования вещества.
Для мгновенной скорости: 

Дата добавления: 2021-03-18; просмотров: 409;











