Статистическая интерпретация понятия энтропии
Макроскопическое состояние включает в себя множество микроскопических состояний. Их число для различных систем может подсчитываться по-разному. По Больцману макроскопическое состояние определяется количеством частиц на каждом энергетическом уровне. Частицы имеют свой номер, а полная энергия системы постоянна. Микроскопические состояния отличаются друг от друга распределением частиц по уровням энергий. Например, система из трех молекул, которые располагаются на трёх энергетических уровнях, а полная энергия системы равна пяти условным единицам, описывается двумя макроскопическими состояниями:
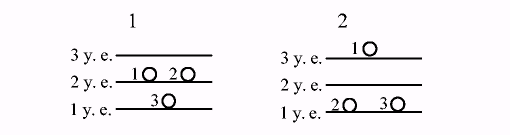
Каждому из них соответствуют по три микроскопических состояния (W1=3, W2=3):
W =  = 3
= 3
В термодинамике мы имеем дело с системами, состоящими из огромного числа частиц, с множеством макросостояний с различными W.
Больцман вывел соотношение, связывающее абсолютную энтропию с числом микроскопических состояний системы, соответствующих данному макроскопическому состоянию (или термодинамической вероятностью):
S = k·1пW,
Где k =R/NA = 1,38 • 1023Дж • К -1 — постоянная Больцмана, а W— число микроскопических состояний системы.
Из формулировки второго начала термодинамики следует, что в изолированной системе при самопроизвольном процессе энтропия возрастает. Система будет самопроизвольно стремиться к макросостоянию с максимальным W. Отсюда энтропию можно рассматривать как меру хаоса системы.
При абсолютной температуре Т = 00 К чистые химические вещества образуют идеальные кристаллы, и их состояние можно описать только одним способом (W = 1), а логарифм единицы равен нулю, а значит и энтропия при этой температуре равна нулю. Пользуясь этим, можно сформулировать третье начало термодинамики как:
Дата добавления: 2021-03-18; просмотров: 395;











